|
Fosforylacja oksydacyjna
Fosforylacja oksydacyjnaFosforylacja oksydacyjna u eukariotów zachodzi dzięki łańcuchowi transportu elektronów w mitochondriach. NADH i bursztynia wytworzone w cyklu kwasu cytrynowego są utleniane wytwarzając energię niezbędną do syntezy ATP. Fosforylacja oksydacyjna – jest
szlakiem metabolicznym
, w którego wyniku
energia
uwalniana podczas utleniania zredukowanych
nukleotydów
przekształcana jest w energię
ATP
. Organizmy żywe wykorzystują wiele różnych związków organicznych, jednak aby wytworzyć z nich energią przydatną
metabolicznie
, cząsteczki ATP, w większości przeprowadzają fosforylację oksydacyjną. Szlak ten jest dominujący ze względu na wysoką efektywność w porównaniu do alternatywnych sposobów syntezy ATP, czyli
fermentacji
Podczas fosforylacji oksydacyjnej, w wyniku szeregu
reakcji redoks
,
elektrony
przenoszone są ze zredukowanych nukleotydów,
NADH
i
FADH
2, na pełniący funkcję akceptora elektronów
tlen
. Zachodzące reakcje prowadzą do zmagazynowania energii, służącej następnie do syntezy ATP. W komórkach
eukariotycznych
, szereg reakcji redoks zachodzi na kompleksach
białkowych
znajdujących się w
mitochondriach
. W komórkach
prokariotycznych
kompleksy białkowe zlokalizowane są w błonach komórkowych. Zestaw
enzymów
biorących udział w przenoszeniu elektronów określa się jako
łańcuch oddechowy
. U eukariotów składa się on z pięciu głównych enzymów, u prokariotów odnaleziono wiele różnych enzymów pełniących funkcję donorów i akceptorów elektronów. Energia uwalniana podczas transportu elektronów w łańcuchu oddechowym zużywana jest do przenoszenia
protonów
przez wewnętrzną błonę mitochondrialną, proces ten przez jego odkrywcę został nazwany
chemiosmozą
.
Energia potencjalna
gromadzona jest w postaci gradientu
pH
i
potencjału elektrycznego
w poprzek błony. Zgromadzona w tej formie energia wykorzystywana jest przez kompleks enzymatyczny
syntazy ATP
, który pozwala protonom przejść przez błonę zgodnie z gradientem stężeń. Enzym ten zamienia jednocześnie energię gradientu pH i elektrycznego na energię wiązań chemicznych ATP, wytwarzanego przez przyłączenie do
ADP
reszty
kwasu ortofosforowego
, czyli reakcji fosforylacji. Niezwykłość reakcji syntezy ATP związana jest z obracaniem się części enzymu napędzanej przepływającymi protonami, przypominając działanie silnika elektrycznego. Obrót części enzymu odłącza wytworzoną cząsteczkę ATP. Fosforylacja oksydacyjna jest ważnym procesem metabolicznym, jednak jej zachodzenie prowadzi do powstawania
reaktywnych form tlenu
, takich jak
nadtlenek wodoru
oraz wolnych rodników, niszczących komórki, a w efekcie powodujących choroby i prawdopodobnie przyspieszających starzenie się. Enzymy przeprowadzające ten szlak metaboliczny są wrażliwe na wiele leków i trucizn, takich jak
cyjanek
. WstępFosforylacja oksydacyjna zachodzi dzięki dostarczaniu
energii
w szeregu reakcji określanych jako łańcuch oddechowy i zużywaniu zmagazynowanej energii w reakcji przeprowadzanej przez syntazę ATP. Pierwsze i druga reakcja są ze sobą sprzężone. Oznacza to, że żadna nie może zachodzić bez zachodzenia drugiej. Przepływ elektronów z donorów w postaci cząsteczek NADH na akceptory w postaci cząsteczek tlenu, odbywający się przez szereg przenośników biorących udział w łańcuchu transportu elektronów, jest procesem
egzoenergetycznym
– uwalniającym energię. Synteza ATP jest zaś procesem
endoenergetycznym
który, aby zachodzić, wymaga dostarczenia energii. Zarówno łańcuch oddechowy, jak i synteza ATP zachodzi na błonach białkowo-lipidowych. Energia z łańcucha transportu elektronów jest przenoszona na syntazę ATP dzięki wytworzeniu różnicy stężeń jonów w poprzek błony, nazywanej
gradientem elektrochemicznym
. Proces przenoszenia
protonów
przez błonę został nazwany
chemiozmozą
[1]. Przenoszenie protonów przez błonę odbywa się dzięki enzymom obecnym w błonach, tłoczącym protony z jednej strony na drugą podczas zachodzenia łańcucha transportu elektronów i określanych nazwą
pompy protonowe
. Enzymy te podobnie jak urządzenia elektryczne wykonują pracę gdy przepływa przez nie prąd elektryczny. Powstający, w efekcie ich pracy, gradient elektrochemiczny, nazywany często siłą protonomotoryczną, składa się z dwóch elementów: różnicy stężeń protonów (gradient pH) oraz różnicy
potencjałów
, wynikającej z ładunków przemieszczanych cząsteczek (po jednej stronie błony istnieje ładunek ujemny, po drugiej dodatni). W przypadku
mitochondriów
większe znaczenie odgrywa różnica potencjałów, a w przypadku
chloroplastów
większe znaczenie ma gradient pH[2]. Syntaza ATP zużywa energię gradientu elektrochemicznego, pozwalając przejść ładunkom (protonom) z powrotem przez błonę[3]. Enzym ten działa podobnie jak silnik elektryczny wykorzystując energię w postaci siły protonomotorycznej do obracania jednym z białek kompleksu. Obroty umożliwiają wytworzenie ATP. Ilość energii wytworzona podczas fosforylacji oksydacyjnej jest zdecydowanie większa od ilości produkowanych podczas zachodzenia
fermentacji
.
Glikoliza
dostarcza jedynie 2 cząsteczki ATP, podczas gdy w procesie fosforylacji oksydacyjnej z 10 cząsteczek NADH i 2 bursztynianu, powstałych przy pełnym utlenieniu cząsteczki
glukozy
do wody i dwutlenku węgla powstaje około 30-36 cząsteczek ATP[4]. Podana ilość ATP jest maksymalną teoretyczną wydajnością, w rzeczywistości cześć protonów przenika przez błonę, omijając syntazę ATP i obniżając wydajność zamiany gradientu elektrochemicznego na ATP[5]. Cząsteczki przenoszące elektrony i protonyRedukcja
koenzymu Q
z formy utlenionej –
ubichinonu
, (Q), do formy zredukowanej – ubichinolu, (QH 2). Zachodzenia łańcucha oddechowego prowadzi do przemieszczania są zarówno protonów, jak i elektronów. Podczas przemieszczania elektronów z donorów na akceptory następuje przeniesienie protonów przez błonę białkowo-lipidową. W procesie uczestniczą związki budujące błony oraz cząsteczki rozpuszczalne. W mitochondrialnym łańcuchu oddechowym elektrony przenoszone są między innymi w przestrzeni międzybłonowej przez niewielkie białko rozpuszczalne,
cytochrom c
[6]. Cząsteczka ta przenosi jedynie elektrony dzięki redukcji i utlenianiu atomów
żelaza
zawartego w
hemie
, będącego składnikiem cytochromu. Cytochrom c został także wykryty w
przestrzeni periplazmatyczne
części bakterii[7]. W wewnętrznej błonie mitochondrialnej,
lipofilny
przenośnik elektronów,
koenzym Q10
(Q), przenosi zarówno elektrony, jak protony, dzięki cyklicznej redukcji i utlenianiu[8]. Mała cząsteczka
benzochinonu
, o silnie
hydrofobowym
charakterze może swobodnie
dyfundować
w błonie. Po przyjęciu dwóch elektronów i dwóch protonów ubichinon przekształca się w formę zredukowaną –
ubichinol
(QH2). Gdy QH2 podczas utleniania przekazuje dwa elektrony i uwalnia dwa protony, powraca do swojej formy utlenionej – ubichononu. W efekcie dzięki lokalizacji miejsca redukcji Q po jednej stronie błony, a miejsca utleniania QH2 po drugiej, ubichinon bierze udział w przenoszeniu protonów przez błonę[9]. U części bakterii poza ubichinonem w łańcuchu transportu elektronów uczestniczą inne chinony, na przykład
menachinon
[10] Białka uczestniczące w łańcuchu oddechowym przenoszą elektrony dzięki obecności grup flawinowych[11][3],
centrów żelazo-siarkowych
i cytochromów. Istnieje kilka typów centrów żelazo-siarka. Najprostsze, ze znalezionych w łańcuchu oddechowym, zawiera dwa atomu żelaza i dwa atomu nieorganicznej siarki i jest określane jako centrum [2Fe–2S]. Drugi rodzaj, nazywany [4Fe–4S], zawiera sześcian z czterech atomów żelaza i czterech siarki. Każdy z atomów żelaza wchodzących w skład centrów jest koordynowany przez
aminokwas
, zwykle grupę -SH
cysteiny
. Jony metalu, tworzącego kofaktor, ulegają redukcji podczas przenoszenia elektronów przez przenośniki białkowe. W tym przypadku wraz z elektronem nie są przemieszczane protony. Elektrony mogą pokonywać stosunkowo duże odległości podczas przemieszczania się przez szereg kofaktorów[12]. Następuje to dzięki
zjawisku tunelowemu
, które umożliwia szybkie pokonanie odległości mniejszych niż 1,4 10-9 m[13]. Łańcuch transportu elektronów u eukariotów
Wiele
katabolicznych
szlaków metabolicznych, takich jak
glikoliza
,
cykl kwasu cytrynowego
, β-oksydacja, prowadzi do wytworzenia NADH.
Koenzym
ten zawiera elektrony, które mają wysoki
potencjał standardowy
, prowadzą do uwolnienia dużej ilości energii podczas utleniania. Komórka nie uwalnia całej tej energii natychmiast, w sposób niekontrolowany. Elektrony są pobrane z NADH przeniesione na tlen przez kilka enzymów, których każdy uwalnia tylko cześć energii. Ten zestaw enzymów, zawierający kompleksy od I do IV, nazywany jest łańcuchem transportu elektronów i znajduje się w wewnętrznej błonie mitochondrialnej. W reakcjach łańcucha oddechowego utleniany jest także
bursztynian
, jednak wchodzi do szlaku w dodatkowym punkcie. W komórkach
eukariotycznych
, enzymy przenoszące elektrony, wykorzystują energię uwalnianą podczas utleniania NADH do przeniesienia
protonów
przez wewnętrzną błonę mitochondrialną do przestrzeni międzybłonowej i wytwarzają
gradient elektrochemiczny
w poprzek błony. Energia zmagazynowana w postaci gradientu zużywana jest przez syntazę ATP do wytwarzania ATP. Fosforylacja oksydacyjna w mitochondriach eukariotów, jest najlepiej poznanym przykładem tego procesu. Mitochondria są obecne u prawie wszystkich eukariotów z wyjątkiem
oddychających beztlenowo
pierwotniaków takich jak
Trichomonas vaginalis
oraz niektórych grzybów, u których protony przekształcane są do wodoru w zmodyfikowanych mitochondriach określanych jako
hydrogenosomy
[14][15]. Oksydoreduktaza NADH-koenzym Q (Kompleks I)
Oksydoreduktaza NADH-koenzym Q
, nazywana także dehydrogenazą NADH lub kompleksem I, jest pierwszym białkiem łańcucha transportu elektronów[16]. U ssaków kompleks I jest ogromnym
enzymem
, składającym się z 46 podjednostek o łącznej masie około 1000
kDa
[17]. Struktura kompleksu została dobrze poznana jedynie u bakterii[18], u większości organizmów kompleks ma kształt litery L z pionowym ramieniem umieszczonym w błonie a pionowym skierowanym do wnętrza mitochondrium [19][20]. Geny kodujące poszczególne podjednostki, podobnie jak ma to miejsce dla wielu enzymów mitochondrialnych, zawarte są zarówno w
jądrze komórkowym
, jak i
genomie mitochondrialnym
. Reakcja katalizowana przez enzym polega na przeniesieniu dwóch elektronów z NADH na koenzym Q10 (ubichinon, Q), związek lipofilny swobodnie dyfundujący w błonie mitochondrialnej: 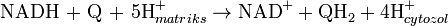 Reakcja rozpoczynająca łańcuch transportu elektronów rozpoczyna się od przyłączenia cząsteczki NADH do kompleksu I i oderwaniu dwóch elektronów. Elektrony przekazywane są na kompleks przez
grupę prostetyczną
wchodzącą w skład enzymu,
mononukleotyd flawinowy
(FMN). Przekazanie dwóch elektronów na FMN przekształca go w zredukowaną formę, FMNH2. Następnie elektrony przenoszone są przez kolejne
centra żelazo-siarka
, drugi rodzaj grup prostetycznych obecnych w kompleksie[18]. W enzymie znajdują się centra [2Fe-2S] oraz [4Fe-4S]. Podczas przejścia przez kompleks dwóch elektronów cztery protony przemieszczane są z macierzy mitochondrialnej do przestrzeni międzybłonowej. Mechanizm przenoszenia protonów nie jest w pełni poznany, prawdopodobnie dochodzi do zmian konformacyjnych w wyniku których protony przyłączone po stronie macierzy mitochondrialnej zostają przeniesione na stronę przestrzeni międzybłonowej i tam odłączone od białka[21]. Pobrane elektrony poprzez centra żelazo-siarka przenoszone są ostatecznie na cząsteczkę ubichinonu w błonie[16]. Zredukowanie ubichinonu również przyczynia się do wytworzenia gradientu protonowego, ponieważ oba przyłączane protony pobierane są z macierzy mitochondrialnej, co prowadzi do wytworzenia
ubichonolu
(QH2). Oksydoreduktaza bursztynian-ubichinon (kompleks II)
Oksydoreduktaza bursztynian-ubichinon
, określana także jako kompleks II lub dehydrogenaza bursztynianowa, jest drugim punktem wejścia elektronów do łańcucha transportu elektronów[22]. Jest to szczególny kompleks, który jest zarówno enzymem cyklu kwasu cytrynowego, jak i łańcucha oddechowego. Kompleks II składa się z czterech podjednostek oraz zawiera kofaktor w postaci
dinukleotydu flawinoadeninowego
(FAD), centra żalazo-siarka oraz grupę
hemową
, która nie uczestniczy w przenoszeniu elektronów na koenzym Q, lecz prawdopodobnie odgrywa rolę w zmniejszeniu produkcji reaktywnych form tlenu [23][24]. Enzym utlenia
bursztynian
do
fumaranu
redukując jednocześnie ubichinon. W reakcji tej uwalniane jest mniej energii niż podczas utleniania NADH, nie dochodzi również do przemieszczania protonów przez wewnętrzną błonę mitochondrialną. Kompleks II nie bierze więc udziału w wytwarzaniu gradientu protonowego.  U niektórych eukariotów, takich jak należąca do
pasożytniczych nicieni
Ascaris suum
, enzym zbliżony do kompleksu II, reduktaza fumaranu (oksydoreduktaza menachinon:fumaran, QFR - ang. menaquinol:fumarate oxidoreductase), przeprowadza reakcję odwrotną redukując fumaran. Pozwala to przeżyć
pasożytowi
w warunkach beztlenowych panujących w
jelicie grubym
, poprzez przeprowadzanie beztlenowej fosforylacji oksydacyjnej, z fumaranem jako akceptorem elektronów[25]. Innym przykładem nietypowego wykorzystania kompleksu II jest
pasożytniczy pierwotniak
wywołujący malarię
Plasmodium falciparum
. U tego organizmu odwrócenie działania kompleksu II umożliwi odtwarzanie ubichinonu, który jest następnie zużywany w wyjątkowym procesie biosyntezy
pirymidyn
[26]. Oksydoreduktaza flawoproteina przenosząca elektron-ubichinonOksydoreduktaza flawoproteina przenosząca elektrony-ubichinon (oksydoreduktaza ETF-Q), nazywana także dehydrogenazą flawoproteiny przenoszącej elektrony, jest trzecim punktem wejścia do łańcucha transportu elektronów. Jest to enzym odbierający elektrony od flawoproteiny przenoszącej elektrony występującej w macierzy mitochondrialnej i redukujący pulę ubichinonu w błonie[27]. Enzym zawiera flawinę i centrum żelazo-siarka typu [4Fe-4S], jednak w przeciwieństwie do innych kompleksów nie jest
białkiem transbłonowym
, lecz pozostaje związany z wewnętrzną powierzchnią błony[28]. 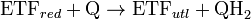 U ssaków enzym odgrywa ważną rolę w
β-oksydacji
kwasów tłuszczowych
, katabolizmie
aminokwasów
i
choliny
, spełniając funkcję akceptora elektronów dehydrogenazy
acylo-CoA
[29][30]. U roślin, oksydoreduktaza ETF-Q nie bierze udziału w β-oksydacji, jednak odgrywa ważną rolę w metabolizmie podczas długich okresów ciemności[31]. Oksydoreduktaza koenzym Q-cytochrom c (kompleks III)Kompleks III,
Oksydoreduktaza koenzym Q-cytochrom c
przenosi elektrony z ubichinolu na cytochrom c w dwóch etapach. Podczas utleniania dwóch cząsteczek QH 2, po stronie zewnętrze błony, powstaje dodatkowa cząsteczka QH 2 po stronie wewnętrznej.
Oksydoreduktaza koenzym Q-cytochrom c
nazywana także reduktazą cytochromu c, kompleksem cytochromów bc1 lub kompleksem III[32][33]. U ssaków enzym składa się z dwóch identycznych podjednostek, z których każda składa się z 11 podjednostek białkowych, centrum żelazo-siarka [2Fe-2S] i trzech
cytochromów
: cytochromu c1 i dwóch cytochromów b[34]. Cytochromy są białkami przenoszącymi elektrony, zawierającymi jedną lub więcej grup
hemowych
. Atomy żelaza obecne w kompleksie III znajdują się na przemian na +2 lub +3 stopniu utlenienia, przyjmując lub oddając elektron. Reakcja katalizowana przez kompleks III polega na utlenieniu cząsteczki
ubichinolu
i redukcji dwóch cząsteczek
cytochromu c
, białka zawierającego hem, luźno związanego z błoną mitochondrialną. W przeciwieństwie do cząsteczki koenzymu Q, przenoszącej dwa elektrony, cytochrom c przenosi tylko jeden elektron.  Ze względu na możliwość przeniesienia tylko jednego elektronu z cząsteczki QH2 na cytochrom c, reakcje zachodzące na kompleksie III są bardziej złożone niż reakcje na pozostałych kompleksach i zachodzą w dwóch etapach nazywanych
cyklem Q
[35]. W pierwszym etapie z kompleksem związane są trzy substraty, utleniana cząsteczka QH2, cytochrom c oraz cząsteczka ubichinonu. Jeden z elektronów pobranych z ubichinolu przekazywany jest na cytochrom c. Drugi elektron przekazywany jest do cząsteczki ubichinonu przyłączonej po stronie macierzy mitochondrialnej. Protony powstające po pobraniu elektronów z cząsteczki QH2 uwalniane są do przestrzeni międzybłonowej. Cząsteczka ubichinonu redukowana po przeciwnej stronie kompleksu przyłącza protony z macierzy mitochondrialnej. Po odebraniu elektronów z ubichinolu odłącza się on od kompleksu. To samo dzieje się ze zredukowanym cytochromem c. Druga cząsteczka ubichinonu, na którą został przeniesiony jeden elektron tworzy semichinon i pozostaje związana z kompleksem. W drugim etapie do enzymu przyłączona zostaje następna cząsteczka QH2 i po raz kolejny jeden z elektronów przenoszony jest na cytochrom c a drugi na na związaną cząsteczkę semichinonu. W efekcie semichinon zostaje zredukowany do QH2, a dwa dodatkowe protony poprane z macierzy mitochondrialnej. Powstała cząsteczka QH2 odrywa się od kompleksu i może zostać utleniona w części utleniającej enzymu[36]. Utlenianie koenzymu Q do ubichinonu po zewnętrze stronie błony i redukcja do ubichinolu po stronie wewnętrznej, daje efekt przenoszenia protonów przez błonę, co prowadzi do zwiększenia gradientu elektrochemicznego[3]. Dwa etapy utleniania ubichinolu zwiększają efektywność przenoszenia protonów. Bez zachodzenia cyklu Q redukcji jednej cząsteczki cytochromu c towarzyszyłoby przeniesienie przez błonę tylko jednego protonu[3]. Oksydaza cytochromu c (Kompleks IV)
Oksydaza cytochromu c
, określana także jako kompleks IV, jest ostatnim enzymem łańcucha transportu elektronów[37]. Kompleks IV mitochondriów ssaków zbudowany jest z 13 podjednostek, dwóch cząsteczek hemu oraz wielu kofaktorów w postaci jonów metali - trzech atomów
miedzi
, jednego
magnezu
i jednego
cynku
[38]. Enzym katalizuje końcową reakcje łańcucha oddechowego przenosząc elektrony na tlen i jednocześnie przemieszczając protony przez błonę[39]. Tlen po przyjęciu elektronów ulega redukcji przyłączając protony z macierzy mitochondrialnej, co prowadzi do powstania wody. Zarówno przenoszenie protonów w poprzek błony, jak i zużywanie, po stronie macierzy mitochondrialnej w reakcji powstawania wody, prowadzi do zwiększenia gradientu protonowego. Reakcja katalizowana polega na utlenianiu cytochromu c i redukcji tlenu według równania: 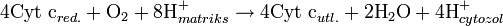 Alternatywne reduktazy i oksydazyU wiele organizmów eukariotycznych w łańcuchu transportu elektronów mogą brać także enzymy nie opisane powyżej. W mitochondriach
roślin
występują dodatkowe enzymy, które mogą utleniać cytozolowe NADH lub NADPH po stronie przestrzeni międzybłonowej i także przenosić elektrony na pulę ubichinonu[40]. Enzymy te nie przenoszą protonów przez błonę mitochondrialną, a tym samym nie biorą udziału w wytwarzaniu gradientu elektrochemicznego[41]. Innym przykładem odmiennego łańcucha transportu elektronów jest występowanie
oksydazy alternatywnej
, która występuje w komórkach roślin, części
grzybów
,
protistów
i prawdopodobnie niektórych zwierząt[42][43] Enzym ten przenosi elektrony bezpośrednio z ubichinolu na tlen, z pominięciem kompleksów III i IV, nie wytwarzając gradientu elektochemicznego[44]. Transport elektronów z udziałem alternatywnych oksydaz NAD(P)H i ubichinolu w znikomym stopniu prowadzi do syntezy ATP w stosunku zwykłej drogi. Korzyści wynikające ze skróconego łańcucha oddechowego nie zostały do końca wyjaśnione. Wiadomo, jednak że oksydaza alternatywna produkowana jest w odpowiedzi na stres w postaci zimna,
reaktywnych form tlenu
, infekcji patogenów i innych czynników zmniejszających wydajność pełnego łańcucha transportu elektronów[45][46]. Alternatywne drogi przenoszenia elektronów mogą, zwiększać odporność organizmów na czynniki szkodliwe, poprzez zwalczanie
stresu oksydacyjnego
[47]. Organizacja kompleksówPoczątkowy model ułożenia kompleksów łańcucha oddechowego zakładał swobodne i niezależne rozmieszczanie w wewnętrznej błonie mitochondrialnej[48]. Nowsze badania wskazują, że enzymy mogą tworzyć większe kompleksy określane jako superkompleksy lub "respirosomy"[49]. W tym modelu kompleksy zorganizowane są w zbiory wzajemnie oddziałujących enzymów[50]. Takie zespoły pozwalałyby przenosić substraty pomiędzy poszczególnymi kompleksami, zwiększając szybkość i wydajność transferu elektronów[51]. W superkompleksach występujących u ssaków, niektóre elementy moga być obecne w wiekszych ilościach niż pozostałe, a stosunek pomiędzy kompleksami I/II/III/IV i syntazą ATP wynosiłby około 1:1:3:7:4[52]. Jednakże istnienie superkompleksów nie jest pewne, a cześć wyników nie potwierdza takiego modelu rozkładu kompleksów łańcucha oddechowego[17][53]. Łańcuch transportu elektronów u prokariotówW przeciwieństwie do ogólnego podobieństwa w strukturze i działaniu łańcucha oddechowego w komórkach eukariotycznych, u
bakterii
i
archeanów
istnieje o wiele większa różnorodność enzymów biorących udział w przenoszeniu elektronów. Jako akceptor elektronów może być użyte wiele substancji chemicznych[54]. Podobnie jak u eukariotów transport elektronów przez kolejne przenośniki prowadzi do przenoszenia protonów przez błonę i wytwarzania gradientu elektrochemicznego. Przebieg fosforylacji oksydacyjnej został dobrze poznany na przykładzie
Escherichia coli
u bakterii, jednak u archeanów przebieg procesu jest stosunkowo mało poznany[55]. Główną różnicą w fosforylacji oksydacyjnej pomiędzy komórkami eukariotycznymi a prokariotycznymi jest używanie przez bakterie i archeany wielu rożnych substancji jako donora lub ostatecznego akceptora elektronów. Pozwala to na wzrost organizmów prokariotycznych w wielu różnych warunkach środowiska[56]. Na przykład, u E. coli, fosforylacja oksydacyjna może być napędzana przez liczne pary związków utlenianych i redukowanych, które zostały wymienione w tabeli. Potencjał redoks obrazuje ile energii uwalniane jest podczas utleniania lub redukcji, dla redukcji wartość potencjału jest ujemna a dla utleniania wartości są dodatnie. Jak przedstawiono w tabeli, E. coli może do wytwarzania energii metabolicznej używać związki takie jak mrówczany, wodór, kwas mlekowy jako donory elektronów i azotany, DMSO lub tlen jako akceptory[56]. Wyższy potencjał redoks oznacza uwolnienie większej ilości energii podczas reakcji. Niezwykłą parę tworzą bursztynian/fumaran przy których potencjał redoks jest niema równa zeru. Dlatego też przy utlenianiu bursztynianu konieczny jest silny utleniacz w postaci tlenu lub fumaran może być zredukowany do bursztynianu przy użyciu silnego reduktora, czyli mrówczanu. Te alternatywne reakcje są katalizowane przez odpowiednio dehydrogenazę bursztynianu lub reduktazę fumaranu[58]. Niektóre prokarioty używają par związków o niskim potencjale redoks. Na przykład bakterie
nitryfikacyjne
, takie jak
Nitrobacter
, utleniają azotyny do azotanów, przekazując elektrony na tlen. Niewielka ilość energii uwalniana podczas reakcji wystarcza do przenoszenia protonów przez błonę i syntezy ATP, lecz nie wystarcza do wytworzenia NADH lub NADPH niezbędnych do procesów
anabolicznych
[59]. Ten problem zostaje rozwiązany dzięki oksydoreduktazie azotynowej, która wytwarza wystarczająco duża siłę protonomotoryczną, aby wymusić odwrotny przebieg łańcucha transportu elektronów, powodując wytwarzanie NADH[60][61]. Użycie odpowiednich donorów lub akceptorów elektronów przez prokarioty regulowane jest przez czynniki środowiskowe[62]. Elastyczność procesów metabolicznych jest możliwa dzięki używaniu przez wielu oksydaz i reduktaz tej samej pulu ubichinonu. Pozwala to wielu zestawom enzymów współdziałać, poprzez współdzielenie ubichinonu obecnego w błonach jako związku pośredniego[57]. Łańcuch oddechowy o strukturze modułowej umożliwia łatwą zmianę zestawów enzymów. Poza metaboliczną różnorodnością, prokarioty posiadają także zestaw
izoenzymów
- różnych enzymów, katalizujących te same reakcje. Na przykład, u E. coli występują dwie różne oksydazy ubichinonu, używające tlenu jako akceptora elektronów. W warunkach dobrej dostępności tlenu komórka używa oksydazy o niskim powinowactwie do tlenu, która jest zdolna do przeniesienia dwóch protonów na każdy elektron. Gdy poziom tlenu spadnie komórka przenosi elektrony na tlen poprzez oksydazę, która nie bierze udziału w wytwarzaniu gradientu elektrochemicznego, jednak posiada wysokie powinowactwo do tlenu[63]. Syntaza ATP
Syntaza ATP
. Domena F O tworzy kanał jonowy i trzon oznaczone kolorem niebieskim, domena F 1 oznaczona kolorem czerwonym, jest właściwym enzym tworzącym ATP, błona oznaczona kolorem szarym. Syntaza ATP, nazywana także kompleksem V, jest ostatnim enzymem biorącym udział w szeregu reakcji fosforylacji oksydacyjnej. Enzym ten został znaleziony we wszystkich żywych organizmach, zarówno prokariotycznych, jak i eukariotycznych[64]. Enzym zużywa energię zgromadzoną w postaci gradientu elektrochemicznego do syntezy ATP z ADP i
fosforanu nieorganicznego
(Pi). Do syntezy jednej cząsteczki ATP potrzebne jest przejście przez syntazę od 3 do 4 protonów[65][66], w niektórych komórkach ilość protonów może się zmieniać, w zależności od warunków[67].  Reakcja fosforylacji jest reakcją odwracalną, a przewaga jednego z kierunków reakcji zależy od siły protonomotorycznej. Przy braku gradientu protonowego, syntaza ATP przeprowadza reakcję hydrolizy ATP, przenosząc jednocześnie protony przez błonę. Gdy jednak siła protonomotoryczna jest odpowiednio duża, zachodzi odwrotna reakcja, protony przepływają zgodnie z gradientem stężeń, a ADP łączone jest z Pi z wytworzeniem ATP[64]. Bardzo podobny enzym H+-ATPaza obecna w błonie
wakuoli
, wywołuje obniżenie pH wnętrza
organellum
, przenosząc protony i jednocześnie hydrolizując ATP[68]. Syntaza ATP jest dużym kompleksem, kształtem przypominającym grzyb. U ssaków kompleks syntazy składa się z 16 podjednostek o łącznej masie około 600
kDa
[69]. Domena będąca białkiem błonowym określana jest nazwą Fo i zawiera pierścień zbudowany z podjednostek c oraz kanał jonowy. Trzon wraz z przytwierdzoną do niego częścią kulistą, określany jest nazwą F1, jest miejscem syntezy ATP. Domena F1 składa się z sześciu podjednostek, należących do dwóch grup: trzech podjednostek α i trzech podjednostek β. Trzon łączący część kulista z domeną błonową zawiera tylko jedną podjednostkę γ[70]. Podjednostki α i β wiążą nukleotydy, jednak tylko podjednostka β katalizuje reakcję syntezy ATP. Wystająca z domeny F1, skierowany w stronę błony, to przypominająca pręt podjednostka kotwicząca zespół podjednostek α i β w głównej części kompleksu. Protony przepływając przez kanał jonowy domeny Fo powodują obracanie się zestawu podjednostek c[71]. Obroty prawdopodobnie powodowane są zmianami w
jonizacji
aminokwasów w pierścieniu podjednostek c, co wywołuje zmiany elektrostatyczne , które napędzają pierścień podjednostek c przy kanale jonowym[72]. Obroty pierścienia przenoszone są przez, tworzącą oś, podjednostkę γ do wnętrza podjednostek α i β, które nie mogą się obracać ze względu na tworzącą
stojan
długa podjednostkę w kształcie pręta. Ruch obrotowy podjednostki γ wewnątrz kulistej struktury podjednostek α i β dostarcza energii do centrów aktywnych na podjednostkach β, powodując oderwanie cząsteczek ATP[73]. Mechanizm syntezy ATP. ATP zaznaczono kolorem czerwonym, ADP i fosforan różowym, a obracającą się podjednostkę γ kolorem czarny. Reakcja syntezy ATP zachodzi dzięki mechanizmowi zmian konformacyjnych, centrum aktywne podjednostki β występuje w dwóch cyklicznie zmieniających się stanach[74]. W stanie pierwszym jest otwarte i może przyłączyć cząsteczkę ADP i Pi. Gdy oba substraty zostaną przyłączone białko zmienia kształt, powodując połączenie cząsteczek. Powstała cząsteczka ATP ma wysokie powinowactwo do enzymu i jest z nim silnie związana. Ostatni etap polega na powrocie enzymu do stanu pierwszego, centrum aktywne otwiera się, uwalniając cząsteczkę ATP i pozostając otwarte dla kolejnych substratów. Synteza ATP nie wymaga dostarczenia energii. Energia obrotów podjednostki γ konieczna jest do oderwania wytworzonej cząsteczki ATP (otwarcia centrum aktywnego). U części bakterii i archeanów, synteza ATP napędzana jest nie przepływem protonów przez błonę komórkową, lecz jonów sodowych[75][76]. Archenany takie jak Methanococcus posiadają także syntazę A1Ao, formę enzymu o niewielkim podobieństwie sekwencji aminokwasów do białek syntazy ATP obecnych u pozostałych bakterii i komórek eukariotycznych. Prawdopodobnie u części gatunków forma syntazy A1Ao napędzana jest jonami sodu[77], jednak jest możliwe, że jest tak u wszystkich organizmów z tą postacią enzymu[76]. Reaktywne formy tlenuTlen cząsteczkowy, jako silny utleniacz, jest idealnym końcowym akceptorem elektronów. Redukcja tlenu może jednak powodować powstawanie szkodliwych związków pośrednich[78]. Chociaż przeniesienie czterech elektronów połączone z przyłączeniem czterech protonów prowadzi do powstania wody, która jest całkowicie nieszkodliwa, przeniesienie jednego lub dwóch elektronów prowadzi do powstania, szczególnie reaktywnych jonów
ponadtlenkowych
lub
nadtlenkowych
. 
Reaktywne formy tlenu
i produkty ich reakcji, takie jak rodnik
hydroksylowy
, są bardzo szkodliwe dla komórek, ponieważ powodują utlenianie białek, lipidów i wywołują
mutacje
w
DNA
. Uszkodzenia komórek prowadza do chorób i są jedną z przyczyn starzenia się[79][80]. Kompleks oksydazy cytochromowej bardzo efektywnie przeprowadza redukcję tlenu do wody i produkuje wyjątkowo mało częściowo zredukowanych związków pośrednich, jednak niewielkie ilości jonów ponadtenkowych i nadtlenkowych są wytwarzane podczas działania łańcucha oddechowego[81]. Szczególnie ważną reakcją jest redukcja koenzymu Q na kompleksie III, gdzie jako związek pośredni powstaje, wysoce reaktywny, semiubichinon. Ten niestabilny związek może prowadzić do "wycieku" elektronów, gdy zostaną one przeniesione bezpośrednio na tlen, tworząc nadtlenek.[82]. W celu neutralizacji reaktywnych form tlenu, komórki posiadają systemy licznych przeciwutleniaczy, w tym witaminy C i E, a także enzymy rozkładające związki szkodliwe chroniąc komórkę przed uszkodzeniem. Do enzymów chroniących komórkę przed reaktywnymi formami tlenu należą:
dysmutaza ponadtlenkowa
,
katalaza
i
peroksydazy
[78]. InhibitoryIstnieje kilka dobrze znanych leków i toksyn, hamujących zachodzenie fosforylacji oksydacyjnej. Chociaż każda z tych substancji jest inhibitorem tylko jednego enzymu w łańcuchu transportu elektronów, inhibicja jednego z ogniw zatrzymuje cały proces. Na przykład
oligomycyna
jest inhibitorem syntazy ATP, powoduje, że protony nie mogą przemieścić się z powrotem do macierzy mitochondrialnej[83]. W efekcie kompleksy łańcucha oddechowego przenoszące protony przestają działać, ponieważ nie są w stanie pokonać wysokiego gradientu stężeń. NADH przestaje być utleniany a cykl kwasu cytrynowego ustaje na skutek spadku stężenia NAD+ niezbędnego do działania części enzymów cyklu. | Związek | Zastosowanie | Wpływ na fosforylację oksydacyjną |
|---|
Cyjanki
tlenek węgla
| Trucizny | Hamują zachodzenie łańcucha oddechowego poprzez zablokowanie centrum żelazo-miedź w oksydazie cytochromowej do którego przyłączany jest tlen. W efekcie elektrony nie są przenoszone na tlen[84]. | |
Oligomycyna
|
Antybiotyk
| Jest inhibitorem kompleksu syntazy ATP, blokującym przenoszenie protonów przez domenę Fo[83]. | CCCP
2,4-Dinitrofenol
| Trucizny |
Jonofory
przenoszące jony przez błonę lipidową, uniemożliwiając wytworzenie gradientu. W efekcie następuje rozprzężenie fosforylacji ponieważ nie powstaje wystarczający do syntezy ATP gradient elektrochemiczny[85]. | | Rotenon |
Pestycyd
| Zatrzymuje przenoszenie elektronów z kompleksu I na ubichinon poprzez zablokowanie miejsca wiązania ubichononu[86]. | |
Jabłczan
i
Szczawiooctan
| | Są kompetytywnymi inhibitorami dehydrogenazy bursztynianowej (kompleksu II)[87]. |
Nie wszystkie inhibitory fosforylacji oksydacyjnej są toksynami. W brunatnej tkance tłuszczowej występują podlegające regulacji białka rozprzęgające (UCP), spełniające funkcję kanałów jonowych pozwalających na przejście przez błonę protonów, co prowadzi do rozprzężenia oddychania i syntezy ATP [88]. Szybkie zachodzenie oddychania, nie powiązane z fosforylacją, prowadzi do uwalniania energii w postaci ciepła, co pozwala utrzymać odpowiednią temperaturę ciała zwierzętom podczas
snu zimowego
. Białka rozprzęgające mogą także pełnić bardziej ogólną funkcję w komórkowej odpowiedzi na stres[89]. Historia badańBadania nad fosforylacją oksydacyjną zapoczątkował
Arthur Harden
, który w roku 1906 stwierdził, że fosforan odrywa ważną rolę w
fermentacji
przeprowadzanej przez komórki. Wcześniej wiedziano jedynie o włączaniu w proces
fosforanów
cukrów. [90] Na początku lat czterdziestych XX wieku zależność między utlenianiem węglowodanów a wytwarzaniem ATP zastała wykazana przez Hermana Kalckara, [91] , co potwierdzało tezę o kluczowej roli ATP w przenoszeniu energii, wysuniętej przez
Fritza Lipmanna
w roku 1941. [92] Następnie w roku 1949, Morris Friedkin i Albert L. Lehninger udowodnili, że koenzym NADH jest związkiem łączącym szlaki metaboliczne, cykl kwasu cytrynowego i syntezę ATP[93] Przez kolejne dwadzieścia lat mechanizm wytwarzania ATP pozostawał tajemnicą, a badania naukowców koncertowały się na poszukiwaniu pośredniego związku bogatego w energię, który stanowiłby połączenie reakcji utleniania i fosforylacji[94]. Zagadka została rozwiązana przez
Petera Mitchella
publikacją teorii chemiosmotycznej w roku 1961[95]. Początkowo propozycja Mitchella wzbudzała wątpliwości, jednak doświadczalne potwierdzenie doprowadziło do akceptacji teorii i przyznanie jej twórcy
nagrody Nobla
w roku 1978[96][97]. Dalsze badania koncentrowały się na określeniu, wyizolowaniu i oczyszczeniu enzymów przeprowadzających poszczególne reakcji. Jednym z głównych badaczy zaangażowanych w poznawanie kompleksów łańcucha oddechowego był David E. Green, a kompleksu syntazy ATP Efraim Racker [98] . Przełomem w wyjaśnianiu mechanizmu syntezy ATP był zaproponowany przez
Paula Boyera
w roku 1973 mechanizm zmian konformacyjnych i jego rozwinięcie w postaci katalizowania syntezy ATP przez enzym w wyniku obracania się jego komponentów przedstawione w roku 1982 [99][74]. W kolejnych latach badania nad strukturą enzymów uczestniczących w fosforylacji oksydacyjnej prowadził
John E. Walker
. Obaj, Walker i Boyer, za swoje prace otrzymali Nagrodę Nobla w roku 1997[100]. Zobacz teżPrzypisy- ↑ Mitchell P, Moyle J. Chemiosmotic hypothesis of oxidative phosphorylation. „Nature”. 213 (5072), ss. 137–9 (1967).
doi:10.1038/213137a0
.
PMID 4291593
.
- ↑ Dimroth P, Kaim G, Matthey U.
Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases
. „J. Exp. Biol.”. 203 (Pt 1), ss. 51–9 (2000).
PMID 10600673
.
- ↑ 3,0 3,1 3,2 3,3 Schultz B, Chan S. Structures and proton-pumping strategies of mitochondrial respiratory enzymes. „Annu Rev Biophys Biomol Struct”. 30, ss. 23–65 (2001).
doi:10.1146/annurev.biophys.30.1.23
.
PMID 11340051
.
- ↑ Rich PR.
The molecular machinery of Keilin's respiratory chain
. „Biochem. Soc. Trans.”. 31 (Pt 6), ss. 1095–105 (2003).
PMID 14641005
.
- ↑ Porter RK, Brand MD.
Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes
. „Biochem. J.”. 310 (Pt 2), ss. 379–82 (1995).
PMID 7654171
.
- ↑ Mathews FS. The structure, function and evolution of cytochromes. „Prog. Biophys. Mol. Biol.”. 45 (1), ss. 1–56 (1985).
doi:10.1016/0079-6107(85)90004-5
.
PMID 3881803
.
- ↑ Wood PM. Why do c-type cytochromes exist?. „FEBS Lett.”. 164 (2), ss. 223–6 (1983).
doi:10.1016/0014-5793(83)80289-0
.
PMID 6317447
.
- ↑ Crane FL.
Biochemical functions of coenzyme Q10
. „Journal of the American College of Nutrition”. 20 (6), ss. 591–8 (2001).
PMID 11771674
.
- ↑ Mitchell P. Keilin's respiratory chain concept and its chemiosmotic consequences. „Science”. 206 (4423), ss. 1148–59 (1979).
doi:10.1126/science.388618
.
PMID 388618
.
- ↑ Soballe B, Poole RK.
Microbial ubiquinones: multiple roles in respiration, gene regulation and oxidative stress management
. „Microbiology (Reading, Engl.)”. 145 (Pt 8), ss. 1817–30 (1999).
PMID 10463148
.
- ↑ Johnson D, Dean D, Smith A, Johnson M. Structure, function, and formation of biological iron-sulfur clusters. „Annu Rev Biochem”. 74, ss. 247–81 (2005).
doi:10.1146/annurev.biochem.74.082803.133518
.
PMID 15952888
.
- ↑ Page CC, Moser CC, Chen X, Dutton PL. Natural engineering principles of electron tunnelling in biological oxidation-reduction. „Nature”. 402 (6757), ss. 47–52 (1999).
doi:10.1038/46972
.
PMID 10573417
.
- ↑ Leys D, Scrutton NS. Electrical circuitry in biology: emerging principles from protein structure. „Curr. Opin. Struct. Biol.”. 14 (6), ss. 642–7 (2004).
doi:10.1016/j.sbi.2004.10.002
.
PMID 15582386
.
- ↑ Boxma B, de Graaf RM, van der Staay GW, et al. An anaerobic mitochondrion that produces hydrogen. „Nature”. 434 (7029), ss. 74–9 (2005).
doi:10.1038/nature03343
.
PMID 15744302
.
- ↑ van der Giezen M., Tovar J., Clark CG. Mitochondrion-derived organelles in protists and fungi.. „International review of cytology”, ss. 175–225 (2005).
doi:10.1016/S0074-7696(05)44005-X
.
PMID 16157181
.
- ↑ 16,0 16,1 Hirst J.
Energy transduction by respiratory complex I—an evaluation of current knowledge
. „Biochem. Soc. Trans.”. 33 (Pt 3), ss. 525–9 (2005).
doi:10.1042/BST0330525
.
PMID 15916556
.
- ↑ 17,0 17,1 Lenaz G, Fato R, Genova M, Bergamini C, Bianchi C, Biondi A. Mitochondrial Complex I: structural and functional aspects. „Biochim Biophys Acta”. 1757 (9–10), ss. 1406–20 (2006).
doi:10.1016/j.bbabio.2006.05.007
.
PMID 16828051
.
- ↑ 18,0 18,1 Sazanov L.A., Hinchliffe P. (2006) Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus. Science 311, 1430–1436
- ↑ Baranova EA, Holt PJ, Sazanov LA. Projection structure of the membrane domain of Escherichia coli respiratory complex I at 8 A resolution. „J. Mol. Biol.”. 366 (1), ss. 140–54 (2007).
doi:10.1016/j.jmb.2006.11.026
.
PMID 17157874
.
- ↑ Friedrich T, Böttcher B. The gross structure of the respiratory complex I: a Lego System. „Biochim. Biophys. Acta”. 1608 (1), ss. 1–9 (2004).
doi:10.1016/j.bbabio.2003.10.002
.
PMID 14741580
.
- ↑ Brandt U, Kerscher S, Dröse S, Zwicker K, Zickermann V. Proton pumping by NADH: ubiquinone oxidoreductase. A redox driven conformational change mechanism?. „FEBS Lett.”. 545 (1), ss. 9–17 (2003).
doi:10.1016/S0014-5793(03)00387-9
.
PMID 12788486
.
- ↑ Cecchini G. Function and structure of complex II of the respiratory chain. „Annu Rev Biochem”. 72, ss. 77–109 (2003).
doi:10.1146/annurev.biochem.72.121801.161700
.
PMID 14527321
.
- ↑ Yankovskaya V., Horsefield R., Tornroth S., Luna-Chavez C., Miyoshi H., Leger C., Byrne B., Cecchini G., Iwata S. (2003) Architecture of succinate dehydrogenase and reactive oxygen species generation. Science 299, 700–704
- ↑ Horsefield R, Iwata S, Byrne B. Complex II from a structural perspective. „Curr. Protein Pept. Sci.”. 5 (2), ss. 107–18 (2004).
doi:10.2174/1389203043486847
.
PMID 15078221
.
- ↑ Kita K, Hirawake H, Miyadera H, Amino H, Takeo S. Role of complex II in anaerobic respiration of the parasite mitochondria from Ascaris suum and Plasmodium falciparum. „Biochim. Biophys. Acta”. 1553 (1–2), ss. 123–39 (2002).
doi:10.1016/S0005-2728(01)00237-7
.
PMID 11803022
.
- ↑ Painter HJ, Morrisey JM, Mather MW, Vaidya AB. Specific role of mitochondrial electron transport in blood-stage Plasmodium falciparum. „Nature”. 446 (7131), ss. 88–91 (2007).
doi:10.1038/nature05572
.
PMID 17330044
.
- ↑ Ramsay RR, Steenkamp DJ, Husain M. Reactions of electron-transfer flavoprotein and electron-transfer flavoprotein: ubiquinone oxidoreductase. „Biochem. J.”. 241 (3), ss. 883–92 (1987).
PMID 3593226
.
- ↑ Zhang J, Frerman FE, Kim JJ. Structure of electron transfer flavoprotein-ubiquinone oxidoreductase and electron transfer to the mitochondrial ubiquinone pool. „Proc. Natl. Acad. Sci. U.S.A.”. 103 (44), ss. 16212–7 (2006).
doi:10.1073/pnas.0604567103
.
PMID 17050691
.
- ↑ Ikeda Y, Dabrowski C, Tanaka K.
Separation and properties of five distinct acyl-CoA dehydrogenases from rat liver mitochondria. Identification of a new 2-methyl branched chain acyl-CoA dehydrogenase
. „J. Biol. Chem.”. 258 (2), ss. 1066–76 (1983).
PMID 6401712
.
- ↑ Ruzicka FJ, Beinert H.
A new iron-sulfur flavoprotein of the respiratory chain. A component of the fatty acid beta oxidation pathway
. „J. Biol. Chem.”. 252 (23), ss. 8440–5 (1977).
PMID 925004
.
- ↑ Ishizaki K, Larson TR, Schauer N, Fernie AR, Graham IA, Leaver CJ.
The critical role of Arabidopsis electron-transfer flavoprotein:ubiquinone oxidoreductase during dark-induced starvation
. „Plant Cell”. 17 (9), ss. 2587–600 (2005).
doi:10.1105/tpc.105.035162
.
PMID 16055629
.
- ↑ Berry E, Guergova-Kuras M, Huang L, Crofts A. Structure and function of cytochrome bc complexes. „Annu Rev Biochem”. 69, ss. 1005–75 (2000).
doi:10.1146/annurev.biochem.69.1.1005
.
PMID 10966481
.
- ↑ Crofts AR. The cytochrome bc1 complex: function in the context of structure. „Annu. Rev. Physiol.”. 66, ss. 689–733 (2004).
doi:10.1146/annurev.physiol.66.032102.150251
.
PMID 14977419
.
- ↑ Iwata S, Lee JW, Okada K, et al. Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex. „Science”. 281 (5373), ss. 64–71 (1998).
doi:10.1126/science.281.5373.64
.
PMID 9651245
.
- ↑ Trumpower BL.
The protonmotive Q cycle. Energy transduction by coupling of proton translocation to electron transfer by the cytochrome bc1 complex
. „J. Biol. Chem.”. 265 (20), ss. 11409–12 (1990).
PMID 2164001
.
- ↑ Hunte C, Palsdottir H, Trumpower BL. Protonmotive pathways and mechanisms in the cytochrome bc1 complex. „FEBS Lett.”. 545 (1), ss. 39–46 (2003).
doi:10.1016/S0014-5793(03)00391-0
.
PMID 12788490
.
- ↑ Calhoun M, Thomas J, Gennis R. The cytochrome oxidase superfamily of redox-driven proton pumps. „Trends Biochem Sci”. 19 (8), ss. 325–30 (1994).
doi:10.1016/0968-0004(94)90071-X
.
PMID 7940677
.
- ↑ Tsukihara T, Aoyama H, Yamashita E, Tomizaki T, Yamaguchi H, Shinzawa-Itoh K, Nakashima R, Yaono R, Yoshikawa S.. TThe whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 A. „Science”. 272 (5265), ss. 1136–44 (1996).
doi:10.1126/science.272.5265.1136
.
PMID 8638158
.
- ↑ Yoshikawa S, Muramoto K, Shinzawa-Itoh K, et al. Proton pumping mechanism of bovine heart cytochrome c oxidase. „Biochim. Biophys. Acta”. 1757 (9–10), ss. 1110–6 (2006).
doi:10.1016/j.bbabio.2006.06.004
.
PMID 16904626
.
- ↑ Rasmusson AG, Soole KL, Elthon TE. Alternative NAD(P)H dehydrogenases of plant mitochondria. „Annual review of plant biology”. 55, ss. 23–39 (2004).
doi:10.1146/annurev.arplant.55.031903.141720
.
PMID 15725055
.
- ↑ Menz RI, Day DA.
Purification and characterization of a 43-kDa rotenone-insensitive NADH dehydrogenase from plant mitochondria
. „J. Biol. Chem.”. 271 (38), ss. 23117–20 (1996).
doi:10.1074/jbc.271.38.23117
.
PMID 8798503
.
- ↑ McDonald A, Vanlerberghe G. Branched mitochondrial electron transport in the Animalia: presence of alternative oxidase in several animal phyla. „IUBMB Life”. 56 (6), ss. 333–41 (2004).
doi:10.1080/1521-6540400000876
.
PMID 15370881
.
- ↑ Sluse FE, Jarmuszkiewicz W. Alternative oxidase in the branched mitochondrial respiratory network: an overview on structure, function, regulation, and role. „Braz. J. Med. Biol. Res.”. 31 (6), ss. 733–47 (1998).
doi:10.1590/S0100-879X1998000600003
.
PMID 9698817
.
- ↑ Moore AL, Siedow JN. The regulation and nature of the cyanide-resistant alternative oxidase of plant mitochondria. „Biochim. Biophys. Acta”. 1059 (2), ss. 121–40 (1991).
doi:10.1016/S0005-2728(05)80197-5
.
PMID 1883834
.
- ↑ Vanlerberghe GC, McIntosh L. Alternative oxidase: From Gene to Function. „Annual Review of Plant Physiology and Plant Molecular Biology”. 48, ss. 703–34 (1997).
doi:10.1146/annurev.arplant.48.1.703
.
PMID 15012279
.
- ↑ Ito Y, Saisho D, Nakazono M, Tsutsumi N, Hirai A. Transcript levels of tandem-arranged alternative oxidase genes in rice are increased by low temperature. „Gene”. 203 (2), ss. 121–9 (1997).
doi:10.1016/S0378-1119(97)00502-7
.
PMID 9426242
.
- ↑ Maxwell DP, Wang Y, McIntosh L.
The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells
. „Proc. Natl. Acad. Sci. U.S.A.”. 96 (14), ss. 8271–6 (1999).
doi:10.1073/pnas.96.14.8271
.
PMID 10393984
.
- ↑ Lenaz G. A critical appraisal of the mitochondrial coenzyme Q pool. „FEBS Lett.”. 509 (2), ss. 151–5 (2001).
doi:10.1016/S0014-5793(01)03172-6
.
PMID 11741580
.
- ↑ Heinemeyer J, Braun HP, Boekema EJ, Kouril R. A structural model of the cytochrome C reductase/oxidase supercomplex from yeast mitochondria. „J. Biol. Chem.”. 282 (16), ss. 12240–8 (2007).
doi:10.1074/jbc.M610545200
.
PMID 17322303
.
- ↑ Schägger H, Pfeiffer K.
Supercomplexes in the respiratory chains of yeast and mammalian mitochondria
. „EMBO J.”. 19 (8), ss. 1777–83 (2000).
doi:10.1093/emboj/19.8.1777
.
PMID 10775262
.
- ↑ Schägger H. Respiratory chain supercomplexes of mitochondria and bacteria. „Biochim. Biophys. Acta”. 1555 (1–3), ss. 154–9 (2002).
doi:10.1016/S0005-2728(02)00271-2
.
PMID 12206908
.
- ↑ Schägger H, Pfeiffer K.
The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes
. „J. Biol. Chem.”. 276 (41), ss. 37861–7 (2001).
doi:10.1074/jbc.M106474200
.
PMID 11483615
.
- ↑ Gupte S, Wu ES, Hoechli L, et al.
Relationship between lateral diffusion, collision frequency, and electron transfer of mitochondrial inner membrane oxidation-reduction components
. „Proc. Natl. Acad. Sci. U.S.A.”. 81 (9), ss. 2606–10 (1984).
doi:10.1073/pnas.81.9.2606
.
PMID 6326133
.
- ↑ Nealson KH. Post-Viking microbiology: new approaches, new data, new insights. „Origins of life and evolution of the biosphere: the journal of the International Society for the Study of the Origin of Life”. 29 (1), ss. 73–93 (1999).
doi:10.1023/A:1006515817767
.
PMID 11536899
.
- ↑ Schäfer G, Engelhard M, Müller V.
Bioenergetics of the Archaea
. „Microbiol. Mol. Biol. Rev.”. 63 (3), ss. 570–620 (1999).
PMID 10477309
.
- ↑ 56,0 56,1 Ingledew WJ, Poole RK. The respiratory chains of Escherichia coli. „Microbiol. Rev.”. 48 (3), ss. 222–71 (1984).
PMID 6387427
.
- ↑ 57,0 57,1 Unden G, Bongaerts J. Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors. „Biochim. Biophys. Acta”. 1320 (3), ss. 217–34 (1997).
doi:10.1016/S0005-2728(97)00034-0
.
PMID 9230919
.
- ↑ Cecchini G, Schröder I, Gunsalus RP, Maklashina E. Succinate dehydrogenase and fumarate reductase from Escherichia coli. „Biochim. Biophys. Acta”. 1553 (1–2), ss. 140–57 (2002).
doi:10.1016/S0005-2728(01)00238-9
.
PMID 11803023
.
- ↑ Freitag A, Bock E. Energy conservation in Nitrobacter. „FEMS Microbiology Letters”. 66 (1–3), ss. 157–62 (1990).
doi:10.1111/j.1574-6968.1990.tb03989.x
.
- ↑ Starkenburg SR, Chain PS, Sayavedra-Soto LA, et al.
Genome sequence of the chemolithoautotrophic nitrite-oxidizing bacterium Nitrobacter winogradskyi Nb-255
. „Appl. Environ. Microbiol.”. 72 (3), ss. 2050–63 (2006).
doi:10.1128/AEM.72.3.2050-2063.2006
.
PMID 16517654
.
- ↑ Yamanaka T, Fukumori Y. The nitrite oxidizing system of Nitrobacter winogradskyi. „FEMS Microbiol. Rev.”. 4 (4), ss. 259–70 (1988).
PMID 2856189
.
- ↑ Iuchi S, Lin EC. Adaptation of Escherichia coli to redox environments by gene expression. „Mol. Microbiol.”. 9 (1), ss. 9–15 (1993).
doi:10.1111/j.1365-2958.1993.tb01664.x
.
PMID 8412675
.
- ↑ Calhoun MW, Oden KL, Gennis RB, de Mattos MJ, Neijssel OM.
Energetic efficiency of Escherichia coli: effects of mutations in components of the aerobic respiratory chain
. „J. Bacteriol.”. 175 (10), ss. 3020–5 (1993).
PMID 8491720
.
- ↑ 64,0 64,1 Boyer PD. The ATP synthase—a splendid molecular machine. „Annu. Rev. Biochem.”. 66, ss. 717–49 (1997).
doi:10.1146/annurev.biochem.66.1.717
.
PMID 9242922
.
- ↑ Van Walraven HS, Strotmann H, Schwarz O, Rumberg B. The H+/ATP coupling ratio of the ATP synthase from thiol-modulated chloroplasts and two cyanobacterial strains is four. „FEBS Lett.”. 379 (3), ss. 309–13 (1996).
doi:10.1016/0014-5793(95)01536-1
.
PMID 8603713
.
- ↑ Yoshida M, Muneyuki E, Hisabori T. ATP synthase—a marvellous rotary engine of the cell. „Nat. Rev. Mol. Cell Biol.”. 2 (9), ss. 669–77 (2001).
doi:10.1038/35089509
.
PMID 11533724
.
- ↑ Schemidt RA, Qu J, Williams JR, Brusilow WS.
Effects of carbon source on expression of F0 genes and on the stoichiometry of the c subunit in the F1F0 ATPase of Escherichia coli
. „J. Bacteriol.”. 180 (12), ss. 3205–8 (1998).
PMID 9620972
.
- ↑ Nelson N, Perzov N, Cohen A, Hagai K, Padler V, Nelson H.
The cellular biology of proton-motive force generation by V-ATPases
. „J. Exp. Biol.”. 203 (Pt 1), ss. 89–95 (2000).
PMID 10600677
.
- ↑ Rubinstein JL, Walker JE, Henderson R.
Structure of the mitochondrial ATP synthase by electron cryomicroscopy
. „EMBO J.”. 22 (23), ss. 6182–92 (2003).
doi:10.1093/emboj/cdg608
.
PMID 14633978
.
- ↑ Leslie AG, Walker JE.
Structural model of F1-ATPase and the implications for rotary catalysis
. „Philos. Trans. R. Soc. Lond., B, Biol. Sci.”. 355 (1396), ss. 465–71 (2000).
doi:10.1098/rstb.2000.0588
.
PMID 10836500
.
- ↑ Noji H, Yoshida M.
The rotary machine in the cell, ATP synthase
. „J. Biol. Chem.”. 276 (3), ss. 1665–8 (2001).
doi:10.1074/jbc.R000021200
.
PMID 11080505
.
- ↑ Capaldi R, Aggeler R. Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor. „Trends Biochem Sci”. 27 (3), ss. 154–60 (2002).
doi:10.1016/S0968-0004(01)02051-5
.
PMID 11893513
.
- ↑ Dimroth P, von Ballmoos C, Meier T.
Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series
. „EMBO Rep”. 7 (3), ss. 276–82 (2006).
doi:10.1038/sj.embor.7400646
.
PMID 16607397
.
- ↑ 74,0 74,1 Gresser MJ, Myers JA, Boyer PD.
Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model
. „J. Biol. Chem.”. 257 (20), ss. 12030–8 (1982).
PMID 6214554
.
- ↑ Dimroth P. Bacterial sodium ion-coupled energetics. „Antonie Van Leeuwenhoek”. 65 (4), ss. 381–95 (1994).
doi:10.1007/BF00872221
.
PMID 7832594
.
- ↑ 76,0 76,1 Becher B, Müller V.
Delta mu Na+ drives the synthesis of ATP via a delta mu Na(+)-translocating F1F0-ATP synthase in membrane vesicles of the archaeon Methanosarcina mazei Gö1
. „J. Bacteriol.”. 176 (9), ss. 2543–50 (1994).
PMID 8169202
.
- ↑ Müller V. An exceptional variability in the motor of archaeal A1A0 ATPases: from multimeric to monomeric rotors comprising 6–13 ion binding sites. „J. Bioenerg. Biomembr.”. 36 (1), ss. 115–25 (2004).
doi:10.1023/B:JOBB.0000019603.68282.04
.
PMID 15168615
.
- ↑ 78,0 78,1 Davies K. Oxidative stress: the paradox of aerobic life. „Biochem Soc Symp”. 61, ss. 1–31 (1995).
PMID 8660387
.
- ↑ Rattan SI. Theories of biological aging: genes, proteins, and free radicals. „Free Radic. Res.”. 40 (12), ss. 1230–8 (2006).
doi:10.1080/10715760600911303
.
PMID 17090411
.
- ↑ Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. Free radicals and antioxidants in normal physiological functions and human disease. „Int. J. Biochem. Cell Biol.”. 39 (1), ss. 44–84 (2007).
doi:10.1016/j.biocel.2006.07.001
.
PMID 16978905
.
- ↑ Raha S, Robinson B. Mitochondria, oxygen free radicals, disease and ageing. „Trends Biochem Sci”. 25 (10), ss. 502–8 (2000).
doi:10.1016/S0968-0004(00)01674-1
.
PMID 11050436
.
- ↑ Finkel T, Holbrook NJ. Oxidants, oxidative stress and the biology of ageing. „{{{czasopismo}}}”, ss. 239–47 (2000).
doi:10.1038/35041687
.
PMID 11089981
.
- ↑ 83,0 83,1 Joshi S, Huang YG. ATP synthase complex from bovine heart mitochondria: the oligomycin sensitivity conferring protein is essential for dicyclohexyl carbodiimide-sensitive ATPase. „Biochim. Biophys. Acta”. 1067 (2), ss. 255–8 (1991).
doi:10.1016/0005-2736(91)90051-9
.
PMID 1831660
.
- ↑ Tsubaki M. Fourier-transform infrared study of cyanide binding to the Fea3-CuB binuclear site of bovine heart cytochrome c oxidase: implication of the redox-linked conformational change at the binuclear site. „Biochemistry”. 32 (1), ss. 164–73 (1993).
doi:10.1021/bi00052a022
.
PMID 8380331
.
- ↑ Heytler PG. Uncouplers of oxidative phosphorylation. „Meth. Enzymol.”. 55, ss. 462–42 (1979).
doi:10.1016/0076-6879(79)55060-5
.
PMID 156853
.
- ↑ Lambert AJ, Brand MD.
Inhibitors of the quinone-binding site allow rapid superoxide production from mitochondrial NADH: ubiquinone oxidoreductase (complex I)
. „J. Biol. Chem.”. 279 (38), ss. 39414–20 (2004).
doi:10.1074/jbc.M406576200
.
PMID 15262965
.
- ↑ Dervartanian DV, Veeger C.. Studies on succinate dehydrogenase. I. Spectral properties of the purified enzyme and formation of enzyme-competitive inhibitor complexes. „Biochim. Biophys. Acta”. 92, ss. 233–47 (November 1964).
PMID 14249115
.
- ↑ Ricquier D, Bouillaud F.
The uncoupling protein homologues: UCP1, UCP2, UCP3, StUCP and AtUCP
. „Biochem. J.”. 345 Pt 2, ss. 161–79 (2000).
doi:10.1042/0264-6021:3450161
.
PMID 10620491
.
- ↑ Borecký J, Vercesi AE. Plant uncoupling mitochondrial protein and alternative oxidase: energy metabolism and stress. „Biosci. Rep.”. 25 (3-4), ss. 271–86 (2005).
doi:10.1007/s10540-005-2889-2
.
PMID 16283557
.
- ↑ Harden A, Young WJ.. The alcoholic ferment of yeast-juice. „Proc. R. Soc. (Lond.)”. B (77), ss. 405–20 (1906).
- ↑ Kalckar HM. Origins of the concept oxidative phosphorylation. „Mol. Cell. Biochem.”. 5 (1–2), ss. 55–63 (1974).
doi:10.1007/BF01874172
.
PMID 4279328
.
- ↑ Lipmann F,. Metabolic generation and utilization of phosphate bond energy. „Adv Enzymol”. 1, ss. 99–162 (1941).
- ↑ Friedkin M, Lehninger AL..
Esterification of inorganic phosphate coupled to electron transport between dihydrodiphosphopyridine nucleotide and oxygen
. „J. Biol. Chem.”. 178 (2), ss. 611–23 (1949).
- ↑ Slater EC.. Mechanism of Phosphorylation in the Respiratory Chain. „Nature”. 172 (4387), s. 975 (1953).
doi:10.1038/172975a0
.
- ↑ Mitchell P.. Coupling of Phosphorylation to Electron and Hydrogen Transfer by a Chemi-Osmotic type of Mechanism. „Nature”. 191 (4784), s. 144 (1961).
doi:10.1038/191144a0
.
PMID 13771349
.
- ↑ Milton H. Saier Jr:
Peter Mitchell and the Vital Force
. [dostęp 2007-08-23].
- ↑
David Keilin's Respiratory Chain Concept and Its Chemiosmotic Consequences
. Nobel Foundation, 1978. [dostęp 2007-07-21].
- ↑ Pullman ME, Penefsky HS, Datta A, and Racker E..
Partial Resolution of the Enzymes Catalyzing Oxidative Phosphorylation. I. Purification and Properties of Soluble, Dinitrophenol-stimulated Adenosine Triphosphatase
. „J. Biol. Chem.”. 235 (11), ss. 3322–3329 (1960).
- ↑ Boyer PD, Cross RL, Momsen W.
A new concept for energy coupling in oxidative phosphorylation based on a molecular explanation of the oxygen exchange reactions
. „Proc. Natl. Acad. Sci. U.S.A.”. 70 (10), ss. 2837–9 (1973).
doi:10.1073/pnas.70.10.2837
.
PMID 4517936
.
- ↑
The Nobel Prize in Chemistry 1997
. Nobel Foundation. [dostęp 2007-07-21].
Bibliografia- Jeremy Mark Berg, John L Tymoczko, Lubert Stryer, Neil D Clarke, Zofia Szweykowska-Kulińska: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007. .
Linki zewnętrzne
Inne hasła zawierające informacje o "Fosforylacja oksydacyjna":
Oddychanie komórkowe
modyfikacjach także pozostałe związki organiczne.U organizmów
eukartiotycznych
cykl Krebsa
,
łańcuch oddechowy
i
Fosforylacja oksydacyjna
zachodzą w
mitochondriach.
Dla najczęściej używanego substratu, glukozy, reakcje oddychania komórkowego ...
Kwas fosforowy
...
Fruktoza
...
Cykl kwasu cytrynowego
...
Łańcuch oddechowy
oraz zatrzymywanie uwolnionej energii w cząsteczce
ATP
. U
eukariotów
transport elektronów i Fosforylacja oksydacyjna zachodzą w wewnętrznej
błonie mitochondrialnej
, u
prokariotów
zaś procesy te ...
Fosforylacja oksydacyjna
Fosforylacja oksydacyjna u eukariotów zachodzi dzięki łańcuchowi transportu elektronów w mitochondriach. NADH ...
Glikoliza
...
Guanozynotrifosforan
...
Heksokinaza
...
Glukozo-6-fosforan
...
Inne lekcje zawierające informacje o "Fosforylacja oksydacyjna":
104. Metabolizm: elementy enzymologii (plansza 24)
świetlnej na chemiczną wiązań
ATP. Wyróżnia się dwa typy tego procesu:
fosforylacja cykliczna
fosforylacja niecykliczna
Fosforylacja oksydacyjna zachodzi u wszystkich
oksybiontów (organizmy wykorzystujące tlen w procesie oddychania) ...
106. Oddychanie komórkowe oraz przemiany lipidów i aminokwasów (plansza 8)
...
105. Metabolizm: odżywianie się autotrofów cz.1 (plansza 16)
...
|