Energie jonizacji obojętnych atomów poszczególnych pierwiastków
Energią jonizacji Ej
pierwiastka
nazywa się minimum
energii
, jaką należy użyć, by oderwać
elektron
od
atomu
tego
pierwiastka
w
stanie gazowym
. Energia jonizacji obojętnych atomów zależy od
liczby atomowej
i waha się w granicach od kilku do dwudziestu kilku
eV
. Jest ona równa energii najsłabiej związanego
elektronu walencyjnego
. Z rysunku widać, że największą energię jonizacji mają neutralne atomy
gazów szlachetnych
, co jest związane z faktem, że pierwiastki te mają zapełnione
powłoki walencyjne
. Najniższą energię jonizacji mają pierwiastki z pierwszej grupy
układu okresowego
posiadające na powłoce walencyjnej jeden elektron.
Proces jonizacji opisuje równanie:

W miarę usuwania kolejnych elektronów atomu energia jonizacji powstałego
kationu
rośnie, przy czym największa energia jonizacji związana jest z oderwaniem elektronu z powłoki wewnętrznej. Często mówi się o pierwszej, drugiej, trzeciej itp. energii jonizacji w odniesieniu do oderwania się odpowiednio 1, 2, 3 i więcej
elektronów
od
atomu
. W
układzie okresowym
pierwiastków obserwuje się wzrost energii jonizacji w okresie z lewej na prawo i spadek w grupie z góry na dół.
Niektórzy naukowcy mówiąc o energii jonizacji odnoszą się do określonego stanu elektronowego (
orbitalu atomowego
) a czasem rozpatrują energię jonizacji
cząsteczek
(
twierdzenie Koopmansa
).
Energię jonizacji definiuje i wiąże z
entalpią
zależność:
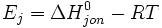
gdzie:
- T -
temperatura
,
- Ej - energia jonizacji,
- R -
stała gazowa
,
 -
entalpia
jonizacji
.
-
entalpia
jonizacji
.
Zobacz też