Entropia –
termodynamiczna
funkcja stanu
, określająca kierunek przebiegu
procesów
spontanicznych
(samorzutnych) w
odosobnionym
układzie termodynamicznym
. Entropia jest miarą stopnia nieuporządkowania układu. Jest
wielkością ekstensywną
[1]. Zgodnie z
drugą zasadą termodynamiki
, jeżeli układ termodynamiczny przechodzi od jednego stanu
równowagi
do drugiego, bez udziału czynników zewnętrznych (a więc spontanicznie), to jego entropia zawsze rośnie. Pojęcie entropii wprowadził niemiecki uczony
Rudolf Clausius
.
W termodynamice klasycznej
W ramach II zasady termodynamiki zmiana entropii (w procesach
kwazistatycznych
) jest zdefiniowana przez swoją
różniczkę zupełną
jako:

gdzie:
- T – temperatura bezwzględna,
- dQ –
ciepło
elementarne, czyli niewielka ilość ciepła dostarczona do układu (
wyrażenie Pfaffa
).
Entropię pewnego stanu termodynamicznego P można wyznaczyć ze wzoru:
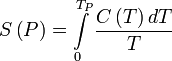
gdzie
- C —
pojemność cieplna
,
- TP — temperatura w stanie P.
Podstawowe równanie termodynamiki fenomenologicznej, w którym występuje entropia, ma postać

gdzie:
- U –
energia wewnętrzna
,
- k – liczba różnych składników,
- T –
temperatura

- p –
ciśnienie

- μi –
potencjał chemiczny
i-tego składnika

W termodynamice statystycznej
Całkowita entropia układu makroskopowego jest równa:

lub

gdzie:
- k –
stała Boltzmanna
,
- W – liczba sposobów, na jakie
makroskopowy stan termodynamiczny
układu (
makrostan
) może być zrealizowany poprzez
stany mikroskopowe
(
mikrostany
),
- pi – prawdopodobieństwo i-tego mikrostanu.
Zatem

jest liczbą
bitów
potrzebnych do pełnego określenia, którą realizację przyjął dany układ.
Praktyczne obliczenie W jest w większości przypadków technicznie niemożliwe, można jednak oszacowywać całkowitą entropię układów poprzez wyznaczenie ich całkowitej pojemności cieplnej poczynając od temperatury 0 K do aktualnej temperatury układu i podzielenie jej przez temperaturę układu.
Ciało pozbawione niedoskonałości, zwane
kryształem doskonałym
, ma w temperaturze 0 bezwzględnego (0
K
) entropię równą 0, gdyż jego stan może być zrealizowany tylko na jeden sposób (każda cząsteczka wykonuje drgania zerowe i zajmuje miejsce o najmniejszej energii). Jest to jedno ze sformułowań
trzeciej zasady termodynamiki
. Oznacza to, że każde rzeczywiste ciało ma w temperaturze większej od zera bezwzględnego entropię większą od zera.
Entropia czarnej dziury
W ogólnej teorii względności, aby opisać czarną dziurę wystarczy podać jej masę, moment pędu i ładunek elektryczny. Zgodnie z tą teorią czarna dziura nie zawiera żadnej informacji ponad te parametry. Żargonowo fizycy mówią, że czarna dziura "nie ma włosów". Jednak oznacza to, że entropia czarnej dziury jest równa 0. Do czarnej dziury wpada materia o niezerowej entropii, zatem przy wpadaniu entropia całego układu się zmniejsza. Wynika z tego, że ogólna teoria względności łamie drugą zasadę termodynamiki. Fizycy zaczęli więc poszukiwać uogólnienia teorii czarnych dziur, tak, żeby pozostawała w zgodzie z termodynamiką. Owocne okazało się rozważenie efektów kwantowych.
Wzór na entropię czarnej dziury powstał przy założeniu, że podczas spadania ciała do czarnej dziury jej masa rośnie i rośnie też jej entropia; proporcjonalny do masy jest
horyzont zdarzeń
, czyli
promień Schwarzschilda
. Ścisły wzór wg
Stephena Hawkinga
ma postać:

gdzie:
- k – stała Boltzmanna,
- A – powierzchnia horyzontu zdarzeń czarnej dziury,
- c –
prędkość światła
,
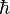 –
stała Plancka
dzielona,
–
stała Plancka
dzielona,- G – stała grawitacyjna.
Wnioski
Według II zasady termodynamiki, każdy
układ izolowany
dąży do stanu równowagi, w którym entropia osiąga maksimum. Zakładając, że Wszechświat jako całość jest układem zamkniętym, powinien on również dążyć do równowagi. Stwierdzenie tego faktu jest jednak stosunkowo trudne do zaobserwowania i dlatego prowadzi się liczne dyskusje czy Wszechświat jest, czy nie jest układem zamkniętym oraz czy rzeczywiście dąży jako całość do równowagi. Przeciwnicy tej koncepcji głoszą, że rozszerzającego się Wszechświata nie można traktować jako układu zamkniętego, gdyż nie można wyznaczyć obszaru, z którego nie wychodziłoby promieniowanie. Wiadomo jedynie, że entropia olbrzymiej większości znanych układów zamkniętych rośnie w kierunku, który nazywamy przyszłością. Tak więc, z tego punktu widzenia, termodynamika określa kierunek upływu czasu (tzw.
termodynamiczna strzałka czasu
).
Według
Boltzmanna
aktualna entropia Wszechświata jest jeszcze bardzo niska, w porównaniu z wartością "docelową", na co dowodem miały być wysokie wartości
fluktuacji
statystycznych zjawisk obserwowanych w skali kosmosu – np. bardzo nierównomierne rozmieszczenie gwiazd w przestrzeni. Współcześnie taka interpretacja entropii jest jednak uważana za całkowicie nieuprawnioną z
kosmologicznego
punktu widzenia.
Zobacz też
Przypisy
- ↑ W opisie układów dalekich od stanu równowagi, klasyczna (nieekstensywna) termodynamika zawodzi. Próby jej rozszerzenia, w oparciu o teorie Rényi'ego i Tsallisa wymagają bardziej ogólnej definicji entropii. Entropie Rényi'ego i Tsallisa są w ogólności nieekstensywne; obejmująca je dziedzina badań nosi nazwę termodynamiki nieekstensywnej