oznacza stężenie, a
f to
współczynnik aktywności
.
W prostych zastosowaniach używa się definicji stężeniowego iloczynu rozpuszczalności, w której aktywność jonów zastępuje się stężeniem:
- Ir = [Mx+]m[Xm-]x
- gdzie wszystkie wartości w nawiasach kwadratowych to
stężenia molowe
określonych jonów.
Iloczyn rozpuszczalności, jako iloczyn stężeń jonów w nasyconym roztworze
elektrolitu
, jest wartością stałą i charakterystyczną dla danej substancji (elektrolitu). Iloczyn stężeń jonów liczony wg powyższego wzoru nie może przekraczać wartości iloczynu rozpuszczalności. Jeżeli iloczyn ten jest mniejszy od wartości granicznej (iloczynu rozpuszczalności), to wówczas cała sól pozostaje w roztworze (nie ma osadu). Jeżeli iloczyn stężeń jonów jest równy wartości granicznej, to mówi się, że roztwór jest nasycony (może, ale nie musi być w kontakcie z osadem). Przekroczenie wartości granicznej iloczynu powoduje strącanie osadu na skutek spontanicznej
krystalizacji
.
Czasami możliwe jest jednak przekroczenie wartości granicznej iloczynu rozpuszczalności. Sytuacja taka jest możliwa, gdy:
- roztwór jest
przesycony
na skutek zahamowania wypadania osadu, np. na skutek dużej
lepkości
lub braku impulsu do rozpoczęcia procesu
krystalizacji
- obliczono stężenie formalnie na podstawie całkowitej ilości jonów wprowadzonych do roztworu - w takiej sytuacji część jonów ulegnie wytrąceniu, aż do zrównania iloczynu rzeczywistych stężeń z wartością graniczną Ir
Rozpuszczalność soli
Proste przekształcenie wzoru na iloczyn rozpuszczalności prowadzi do wzoru określającego rozpuszczalność danej soli w czystej wodzie:
![R_{w} = \sqrt[x+m]{\frac{I_{r}}{x^{x} m^{m}}}](http://upload.wikimedia.org/math/9/7/7/9773ee1e5f5ec8a9c9a7aec2c511a1ea.png)
- gdzie: Rw - to maksymalne stężenie molowe soli.
Rozpuszczalność w roztworze zawierającym inne sole zależy od natury obecnych jonów i cząsteczek.
Jeżeli do roztworu wprowadzimy jony wspólne z daną solą, wówczas rozpuszczalność tej soli ulegnie zmniejszeniu, zgodnie z równaniami:
- dla wspólnego kationu (dodano łatwo rozpuszczalną sól zawierającą jony M w ilości odpowiadającej stężeniu w roztworze CM):
- [mR' + CM]m[xR']x = Ir
- dla wspólnego anionu (dodano łatwo rozpuszczalną sól zawierającą jony X w ilości odpowiadającej stężeniu w roztworze CX jonu X):
- [mR']m[xR' + CX]x = Ir
Skąd otrzymamy zależność:
- gdzie R' to rzeczywista rozpuszczalność analizowanej soli po dodaniu jonów wspólnych, zaś Rw to rozpuszczalność przed dodaniem tych jonów - co oznacza, że dodanie jonów wspólnych zawsze powoduje obniżenie rozpuszczalności soli.
Gdy stężenia jonów wspólnych zbliżają się do stężenia granicznego, dla całej soli równania na rozpuszczalność upraszczają się do postaci:
- dla dużego CM >> Rw:
![x R' = \sqrt[x]{\frac{I_{r}}{C_{M}^{m}}}](http://upload.wikimedia.org/math/e/f/0/ef06b40f72e23fb98bd310dac4f1040c.png)
- dla dużego CX >> Rw:
![m R' = \sqrt[m]{\frac{I_{r}}{C_{X}^{x}}}](http://upload.wikimedia.org/math/2/7/5/275b74fbe739995dbc5440b4c22b0276.png)
Kompleksowanie
Dość częstym zjawiskiem jest tworzenie przez daną
parę jonową
nie tylko trudno rozpuszczalnych soli ale i łatwo rozpuszczalnych
kompleksów
. W takiej sytuacji niewielki dodatek jonu wspólnego spowoduje spadek rozpuszczalności, ale zwiększenie stężenia jonu wspólnego doprowadzi do powstawania kompleksu i w rezultacie sumarycznego zwiększenia ilości rozpuszczonego metalu, pomimo tego, że stężenie wolnego jonu metalu będzie mniejsze. Typowe przykłady to np. kompleksy chlorkowe i jodkowe Ag i Pb (sole są trudno rozpuszczalne).
Efekt solny
Jeżeli w roztworze znajdzie się duże stężenie soli obojętnych (nie mających jonów wspólnych z daną solą trudno rozpuszczalną) wówczas na skutek zmiany (zmniejszenia)
współczynników aktywności
, stężeniowy iloczyn rozpuszczalności wzrośnie, mimo że iloczyn termodynamiczny pozostanie stały. W wyniku tego wzrośnie także rozpuszczalność soli. Zależność tę odzwierciedla analiza rozpuszczalności (R) trudno rozpuszczalnego związku MX:
![I_{r} = [M ^{+}] [X ^{-}] \left( f_{M}^{+} \right) \left( f_{X}^{-} \right)](http://upload.wikimedia.org/math/7/7/7/777f228b3e4f31d11d35a5b379ab56f7.png)
[M + ] = [X − ] = R
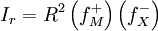
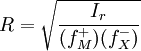
W przypadku zwiększenia się
siły jonowej
(mocy jonowej) roztworu, współczynniki aktywności przyjmują wartości mniejsze od jedności, a więc należy je uwzględnić w obliczeniach.
Hydroliza osadów
Jony, na które dysocjuje w roztworze nasyconym trudno rozpuszczalny związek reagują z wodą z utworzeniem cząsteczek słabo zdysocjowanych zasad lub kwasów. W efekcie stężenie tych jonów maleje i roztwór staje się nienasycony. Zgodnie z definicją iloczynu rozpuszczalności, część osadu musi ulec rozpuszczeniu. Przykładem może być osad fosforanu (V) amonu i magnezu, którego hydrolizę cofa się dodając w nadmiarze roztworu amoniaku.
Wpływ jonów oksoniowych
Jony oksoniowe
([H3O]+) zwiększają rozpuszczalność trudno rozpuszczalnych wodorotlenków oraz soli słabych kwasów. W pierwszym przypadku dodanie do roztworu mocnego kwasu powoduje obniżenie stężenia jonów OH-, a co za tym idzie, zwiększenie stężenia jonów metalu w roztworze. Konsekwencją tego jest wzrost rozpuszczalności osadu wodorotlenku jako całości.
W przypadku soli słabych kwasów wprowadzone do roztworu jony oksoniowe wiążą aniony reszty kwasowej tworząc cząsteczki słabo zdysocjowanych kwasów. Zmniejsza się w ten sposób stężenie wolnych jonów w roztworze, np.


Ponieważ 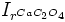 jest wartością stałą, to obniżeniu się stężenia jonów szczawianowych musi towarzyszyć wzrost stężenia jonów Ca2+, czyli zwiększenie rozpuszczalności osadu.
jest wartością stałą, to obniżeniu się stężenia jonów szczawianowych musi towarzyszyć wzrost stężenia jonów Ca2+, czyli zwiększenie rozpuszczalności osadu.