Prawo Daltona – wspólne określenie na dwa różne prawa, sformułowane przez
Johna Daltona
, które są wzajemnie komplementarne:
- prawo ciśnień cząstkowych
- prawo objętości cząstkowych
Prawo ciśnień cząstkowych
Prawo ciśnień cząstkowych zostało opublikowane przez Daltona w
1810
r. Głosi ono:
- "
Ciśnienie
wywierane przez mieszaninę gazów jest równe sumie ciśnień wywieranych przez składniki mieszaniny, gdyby każdy z nich był umieszczany osobno w tych samych warunkach objętości i
temperatury
, jest ono zatem sumą
ciśnień cząstkowych
."
W formie matematycznej można je wyrazić jako:

gdzie:
- p – ciśnienie w mieszaninie k-składnikowej w objętości V i temperaturze T
- pi –
ciśnienie cząstkowe
składnika i w tej samej objętości i temperaturze
Prawo Daltona jest słuszne dla
gazów doskonałych
nie reagujących z sobą. Dla
gazów rzeczywistych
jest słuszne jedynie dla gazów rozrzedzonych i w temperaturze znacznie powyżej
punktu krytycznego
.
Prawo objętości cząstkowych
Prawo objętości cząstkowych głosi:
- "Objętość zajmowana przez mieszaninę gazów jest równa sumie objętości, które byłyby zajmowane przez składniki mieszaniny, gdyby każdy z nich był umieszczony osobno w tych samych warunkach ciśnienia i temperatury, czyli jest równa sumie
objętości cząstkowych
."

gdzie:
- V – objętość mieszaniny k-składnikowej przy ciśnieniu p i temperaturze T
- Vi – objętość cząstkowa składnika i w tej samej temperaturze i ciśnieniu
Wyprowadzenie
Oba prawa można wyprowadzić z
równania Clapeyrona
czyli równania stanu gazu doskonałego. Dla mieszaniny k gazów o liczbie
moli
n (
liczności
), zajmującej objętość V przy ciśnieniu p, zachodzi:
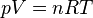
gdzie

- ni – liczba moli poszczególnych składników
Ciśnienie cząstkowe
Jeżeli gaz i jest gazem doskonałym, to zgodnie z równaniem Clapeyrona, w tej objętości wywiera ciśnienie zwane ciśnieniem cząstkowym, określone wzorem:
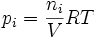
Suma ciśnień cząstkowych gazów i = 1...k wynosi:

Objętość cząstkowa
Podobnie, definiując objętość cząstkową jako objętość składnika i oraz korzystając z równania Clapeyrona można zapisać:

a suma objętości cząstkowych gazów i = 1...k równa jest:

Źródła
Ilustrowana encyklopedia dla wszystkich, Wydawnictwa Naukowo-Techniczne, Warszawa, 1990,