Rodnik metylowy – najprostszy rodnik organiczny
Rodniki –
atomy
lub
cząsteczki
posiadające niesparowane
elektrony
[1], czyli charakteryzujące się
spinem elektronowym
różnym od 0. Niektóre układy o całkowitym spinie równym 0, lecz wykazujące tzw. polaryzację spinową (np. niektóre stany przejściowe) czasem traktowane są jako dwurodniki.
Cechą charakterystyczną rodników jest
paramagnetyzm
, a techniką umożliwiającą ich badanie jest
spektroskopia elektronowego rezonansu paramagnetycznego
(EPR).
Większość elektronów w
atomach
i cząsteczkach występuje parami (po dwa na każdym
orbitalu
). Układ rodnikowy, w którym na pewnym orbitalu jest tylko jeden elektron jest zazwyczaj nietrwały i dąży do przyjęcia lub oddania elektronu – zwykle z udziałem innego atomu lub cząsteczki. Oznacza to, że rodniki są zazwyczaj bardzo reaktywne.
Rodniki mogą być obojętne elektrycznie lub posiadać ładunek, dodatni w kationorodnikach (np. kationorodnik benzenowy C6H6•+), ujemny w anionorodnikach (np. anionorodnik benzenowy C6H6•–)[2]. W "typowych" reakcjach z udziałem rodników ich stężenie w mieszaninie reakcyjnej jest zwykle bardzo niskie, ze względu na ich dużą reaktywność.
Najprostszym rodnikiem jest pojedynczy atom
wodoru
, który składa się z
protonu
i jednego niesparowanego elektronu. Średni czas życia rodnika wodorowego w gazowym wodorze w
temperaturze
pokojowej to ok. 2,5
ns
- co oznacza, że statystycznie tyle czasu mija od powstania tego rodnika do jego związania z drugim rodnikiem i powstania zwykłej cząsteczki wodoru H2. Czasy życia rodników i ich reaktywność zależą od ich struktury. Trwałość rodników
alkilowych
rośnie wraz z ich
rzędowością
. Stabilizujący wpływ ma także
sprzężenie
z sąsiednimi grupami (np. z podwójnym wiązaniem). Szczególnie trwałe rodniki tworzy
trifenylometan
i jego pochodne. Rodnik trifenylometylowy (trytylowy) Tr• (2) istnieje w równowadze z
dimerem
3, a obecność barwnych rodników trytylowych w roztworze sprawia, że ma on żółte zabarwienie[3].
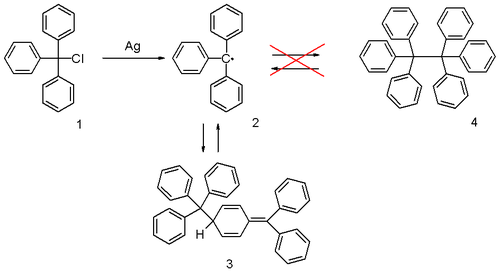 |
Rodnik trifenylometylowy |
W obecności
tlenu
(np. z powietrza) rodniki trytylowe ulegają nieodwracalnemu związaniu w
nadtlenki
Tr-O-O-Tr i roztwór odbarwia się. Po zużyciu całej ilości wprowadzonego tlenu, żółte zabarwienie stopniowo powraca wskutek odtwarzania się rodników trytylowych 2 z dimeru 3[3].
Rodniki są często
centrami aktywnymi
wielu
reakcji chemicznych
takich jak np.
polimeryzacja wolnorodnikowa
oraz występują w minimalnych stężeniach w
cytoplazmie
komórek organizmów żywych, gdzie ich stężenie jest jednak ściśle kontrolowane.
Rodniki powstają np. na skutek homolitycznego rozpadu
wiązań chemicznych
, tj. takiego, w wyniku którego przy obu częściach rozerwanej cząsteczki zostaje po jednym z elektronów, które wcześniej tworzyły wiązanie. Może ono następować pod wpływem naświetlania
promieniowaniem ultrafioletowym
,
promieniowaniem rentgenowskim
, przez bombardowanie elektronami, w wyniku niektórych
reakcji redoks
, a także w wyniku termicznego rozpadu (tzw.
dysocjacji termicznej
) takich związków jak np.
nadtlenki
lub
sole diazoniowe
.
Typowy przykład reakcji, w wyniku której powstają rodniki to np. rozpad cząsteczek
chloru
Cl2 pod wpływem działania światła ultrafioletowego:
- Cl2 + hν → 2 Cl•
Zalecenia nomenklaturowe
Dawniej w znaczeniu rodniki stosowany był termin wolne rodniki[4], co obecnie nie jest zalecane[1]. Nie zaleca się także określania mianem rodniki grup i
podstawników
w cząsteczkach
związków organicznych
[1].
Zobacz też
Przypisy
- ↑ 1,0 1,1 1,2
Radical (free radical)
. IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book").
- ↑
Radical ion
. IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book").
- ↑ 3,0 3,1 J.D. Roberts, M.C. Caserio: Chemia organiczna. Warszawa:
PWN
, 1969.
- ↑
Rodnik
. Encyklopedia PWN. [dostęp 2010-10-21].