Entalpia (H) (zawartość ciepła) — w
termodynamice
wielkość fizyczna będąca
funkcją stanu
mająca wymiar
energii
, będąca też
potencjałem termodynamicznym
, oznaczana przez H, h,I lub χ, którą definiuje zależność:
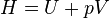
gdzie:
Z powyższego wzoru wynika sens fizyczny entalpii. Entalpia jest równa sumie energii wewnętrznej, czyli energii jaka jest potrzebna do utworzenia układu gdy jest on tworzony w otoczeniu próżni oraz iloczynu pV, który jest równy pracy jaką należy wykonać nad otoczeniem by w danych warunkach uzyskać miejsce na układ.[1]
Wszystkie wielkości definiujące entalpię są funkcjami stanu, dlatego entalpia też jest funkcją stanu.
Nieskończenie małą zmianę entalpii określa wzór:

Dla procesów, zachodzących dla ciał stałych i cieczy pod niezbyt dużym ciśnieniem składniki pdV i Vdp są małe w porównaniu do dU i mogą być pominięte, wówczas zmiana entalpii jest równa zmianie energii wewnętrznej:
Entalpia jako zawartość ciepła
Z definicji entalpii i
I zasady termodynamiki
:

Gdy układ nie wykonuje pracy nieobjętościowej oraz gdy ciśnienie jest stałe, wówczas zmiana entalpii jest równa ciepłu dostarczonemu do układu:
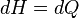
Z tego, że entalpia jest funkcją stanu oraz powyższego wynika, że dla dowolnego procesu, w którym ciśnienie początkowe jest równe ciśnieniu końcowemu, ilość ciepła dostarczonego do układu jest równa zmianie entalpii:

Przemiany przebiegające przy stałym ciśnieniu są bardzo często spotykane w praktyce (np.
kocioł parowy
, przemiany fazowe,
reakcje chemiczne
), stąd entalpia jest bardzo często wykorzystywaną w obliczeniach funkcją stanu.
W termodynamice technicznej przydatne są wielkości termodynamiczne właściwe (odniesione do jednostki masy rozpatrywanego czynnika termodynamicznego). Wprowadza się więc entalpię właściwą:

Dla entalpii właściwej można zapisać wzór definicyjny w następującej postaci:
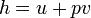
gdzie:
Zależność entalpii od temperatury
Entalpia substancji zależy od jej temperatury. Przy stałym ciśnieniu jest nazywana
pojemnością cieplną
przy stałym ciśnieniu Cp

lub
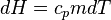
gdzie:
Entalpia standardowa
Entalpia standardowa to entalpia danej substancji w jej czystej postaci w
warunkach standardowych
, to jest przy ciśnieniu 1 bar i temperaturze 298 K. Określa się też entalpię standardową w określonej temperaturze. Zmianę entalpii standardowej oznacza się symbolem  . Oznaczając entalpie jak i entalpie standardowe wprowadza się do symbolu entalpii oznaczenie przemiany
. Oznaczając entalpie jak i entalpie standardowe wprowadza się do symbolu entalpii oznaczenie przemiany  , gdzie przem oznacza przemianę, stosowany jest też zapis
, gdzie przem oznacza przemianę, stosowany jest też zapis 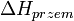 .
.
Entalpie standardowe tworzenia 1 mola (zobacz
Standardowe molowe ciepło tworzenia
) substancji są podawane w tabelach własności fizycznych substancji. Przyjmuje się, że pierwiastki w ich podstawowym stanie w warunkach standardowych mają entalpię równą 0.
Przykłady entalpii standardowych tworzenia: wodór H2 – 0, H – +217,97 kJ/mol, tlen O2 – 0, woda (ciecz) – −285,83 kJ/mol, (gaz) – −241,82 kJ/mol.
Entalpia przemian
Wybrane oznaczenia entalpii przemian| Przemiana | Opis | Oznaczenie |
| Przejście fazowe | faza a → faza b | 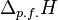 |
| Rozpuszczanie | Substancja rozpuszczana → roztwór | 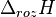 |
| Reakcja | substraty → produkty |  |
| Tworzenie | pierwiastki → związek chemiczny | 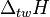 |
Inne
Z definicji oraz wyrażenia na energię wewnętrzną dla procesów odwracalnych:

wynika:
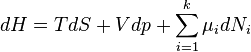
Z zależności tej wynika:
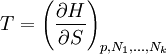 - związek z temperaturą
- związek z temperaturą - związek z objętością
- związek z objętością - związek z
potencjałem chemicznym
- związek z
potencjałem chemicznym
gdzie
Entalpia
gazów rzeczywistych
i innych substancji zależy w sposób bardziej skomplikowany od temperatury, konieczne jest zastosowanie bardziej skomplikowanych zależności, uwzględniających m.in. ciśnienie. Szczególnie skomplikowane jest wyznaczenie entalpii stosowanej w technice
pary wodnej
(np. w
kotłach
i
turbinach parowych
, suszarniach,
wymiennikach ciepła
,
sprężarkach
i
wentylatorach
do
gazów
wilgotnych,
silnikach cieplnych
, zwłaszcza z wtryskiem wody bądź pary wodnej, sieci i węzłów ciepłowniczych i innych), gdyż jej parametry są oddalone w stosunkowo niewielkim stopniu od linii nasycenia i
punktu krytycznego
.
W termodynamice nie jest istotna wartość całkowitej entalpii, lecz jej przyrost lub spadek w danym procesie. Przyrost entalpii występuje w
sprężarkach
, natomiast spadek — w
turbinach cieplnych
.
Moc
maszyny przepływowej
(
turbiny
,
sprężarki
) obliczana jest jako iloczyn wewnętrznego spadku (bądź przyrostu) entalpii
czynnika przepływowego
i
strumienia masy
rozprężanego (lub sprężanego) czynnika.
Zobacz też
Przypisy
Bibliografia