Ozon, tritlen (O3) - jedna z odmian
alotropowych
tlenu
, posiadające silne własności
aseptyczne
i
toksyczne
. Stosowany jest przy wyjaławianiu
wody
oraz pełni ważną rolę w pochłanianiu części
promieniowania ultrafioletowego
dochodzącego ze
Słońca
do
Ziemi
(patrz
dziura ozonowa
).
Właściwości chemiczne i fizyczne
Ozon jest niebieskim
gazem
, o większej
gęstości
od
powietrza
. Powietrze po burzy ma zapach ozonu (powstaje w temperaturze łuku elektrycznego podczas uderzeń piorunów). W stanie wolnym występuje w
atmosferze
, powstaje w górnych warstwach atmosfery pod wpływem promieniowania ultrafioletowego w wyniku rozpadu cząsteczek O2 pod wpływem światła i dalszego łączenia się ich, wg równań:
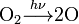

Jest gazem niepalnym (ma jednak zdolność, podobnie, jak
ditlen
- O2, podtrzymywać proces
spalania
), dobrze
rozpuszczalnym
w wodzie, dość nietrwałym:
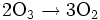
Jest silnym
utleniaczem
:

Ozon może występować w dwu stanach elektronowych: trypletowym i singletowym. Pierwsza z tych form ma charakter
dwurodnika
[4], druga zaś
1,3-dipola
[5]. Najprostszym modelem teoretycznym, pozwalającym jakościowo opisać strukturę elektronową ozonu jest przedstawienie go w formie dwóch struktur
rezonansowych
.
Zastosowania
Wykorzystywany jest do wyjaławiania wody pitnej (
ozonowanie
), pomieszczeń (szczególnie w szpitalach: lampa ozonowa), utleniania
paliwa rakietowego
, a także jako reagent w
ozonolizie
.
Ozon jest jednym z najskuteczniejszych znanych środków dezynfekcyjnych. Działanie bakteriobójcze wykazuje w stężeniu ok. 13 μg/dm3. Nie jest on jednak pozbawiony wad. Jako uboczne produkty ozonowania powstają
aldehydy
i
ozonki
. Ponadto wadą ozonu jest jego nietrwałość, a co za tym idzie, ryzyko wtórnego skażenia uprzednio zdezynfekowanej wody. Stąd konieczność dodatkowego chlorowania wody.
Typowy środek dezynfekcyjny do uzdatniania wody –
chlor
, podczas wstępnego procesu chlorowania wody z zawartymi w niej związkami organicznymi, powoduje powstawanie produktów ubocznych, które są umiarkowanie toksyczne dla ludzi, m.in.
chloroform
i chlorofenole. Trzeba jednak podkreślić, że substancje te tworzą się w bardzo małej ilości i ich szkodliwość jest znacznie mniejsza, niż składników wody nieuzdatnianej, jednak mogą wyraźnie obniżyć jej właściwości organoleptyczne.
Dla porównania, działanie bakteriobójcze ozonu jest około 50 razy skuteczniejsze i 3000 razy szybsze niż chloru. Niestety, ozon ma stosunkowo krótki czas rozkładu, przez co ozonowana woda pozostaje aseptyczna przez krótki czas (tzn. nie można jej bezpiecznie przesyłać długimi rurociągami). Dlatego ozon nie może całkowicie wyeliminować chloru z procesu uzdatniania wody, jednakże może go w istotny sposób ograniczyć, w ilości niezbędnej do utrzymania w sterylności wszystkich nitek sieci wodociągowej po przejściu wody przez stację uzdatniania. Zabieg taki wyraźnie poprawia właściwości organoleptyczne spożywanej wody (brak wyczuwalnego zapachu i smaku chloru oraz mętnego zabarwienia).
Znaczenie biologiczne
W atmosferze spełnia funkcję filtra pochłaniającego
promieniowanie ultrafioletowe
, które emitowane jest przez
Słońce
. Pochłanianie to polega na reakcji rozszczepienia
cząsteczki
ozonu na
tlen
i
rodnik
tlenowy, która jest odwróceniem
reakcji syntezy
ozonu. Przerzedzenie warstwy ozonowej nazywa się
dziurą ozonową
.
Działanie toksyczne na organizm
Ozon jest gazem drażniącym, powoduje uszkodzenie
błon biologicznych
przez reakcje rodnikowe z ich składnikami. Po dostaniu się do komórek może hamować działanie enzymów komórkowych, wstrzymując
oddychanie wewnątrzkomórkowe
. Pierwszymi objawami podrażnienia ozonem (obserwowanym w stężeniach 0,2 μg/dm3) są kaszel, drapanie w gardle, senność i bóle głowy. W większych stężeniach może prowadzić do wzrostu ciśnienia tętniczego, przyspieszenia tętna i obrzęku płuc prowadzącego do zgonu (w stężeniach 9-20 μg/dm3).
Najwyższe dopuszczalne stężenie ozonu w miejscu pracy wynosi 0,1 μg/dm3.
Przypisy
- ↑
WebElements Periodic Table of the Elements
. [dostęp 2010-07-20].
- ↑
Ozon – podsumowanie
(
ang.
). PubChem Public Chemical Database.
- ↑ 3,0 3,1 3,2 CRC Handbook of Chemistry and Physics. Wyd. 83th. Boca Raton: CRC Press, 2003, ss. 4-47.
- ↑ A.W. Mainorov, B.E. Krisyuk, A.A. Popov, Khim. Fiz. 2008 27 50
- ↑ S.E. Wheeler, D.H. Ess, K.N. Houk, J. Phys. Chem. 2008 112 1798
Bibliografia
Witold Seńczuk red.: Toksykologia. Podręcznik dla studentów, lekarzy i farmaceutów Wydanie IV. Warszawa: Wydawnictwo Lekarskie PZWL, 2002.
Zobacz też